|
L'appareil épigastrique des Araignées mâles ANATOMIE ET COMPORTEMENT DES ARANEIDES : VINGT-CINQ ANS DE RECHERCHES (Version
2023)
Par
André LOPEZ
|
Un curieux complexe glandulaire et
sensoriel annexé à l'orifice génital des mâles d' Araignées, associant
des organes sécréteurs, des sensilles et impliqué dans l'induction
spermatique
|
|
Couleurs
conventionnelles :
En noir et italiques, termes anatomiques ; en violet,,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
orange,, parties
les plus importantes
et résumés
; en bleu, liens divers.
|
|
Abréviations
conventionnelles :
M.E.B.
:
(photographie en) microscopie électronique à
balayage
M.E.T. :
(photographie en) microscopie électronique à
transmission
C.H. :
coupe histologique
(microscopie photonique)
|
1 - Introduction
2 - Glandes épigastriques ou
prégonoporales
2.a.-Localisation
et rapports
2.b.- Structure générale
2.c.- Corps glandulaire
2.c.1.-
Histologie
2.c.2.- Ultrastructure
2.c.3.a.- Variations numériques
2.c.3.b.- Variations morphologiques
2.c.3.c .- Variations dans les rapports
2.d. -Canaux
2.d.1.- Histologie
2.d.2.- Ultrastructure
2.e.- Fusules épigastriques
2.e.1. - Formes
2.e.2.- Dispositions
2.e.3.- Puits ("Pits")
2.e.4.- Structure
3 - Organes gonoporaux (ex "glandes gonoporales")
3.a.- Localisation et rapports
3.b.- Histologie
3.c.- Microscopie électronique
4 - Glandes exocrines tégumentaires
4.a.- Microscopie électronique
5 - Commentaires
5.a.- Point de vue anatomique
5.a.1.- Organes prégonoporaux
5.a.2.- Organes gonoporaux
5.b.- Point de vue fonctionnel
5.c.- Point de vue ontogénique
5.d.- Point de vue étho-écologique
5.e.- Point de vue phylogénétique
L’étude de l’appareil épigastrique a débuté
en 1970 sur le conseil amical du Pr Roland Legendre qui fut, avec Jacques
Millot,
l’un des deux pionniers de l’étude
histologique des Araneides.
Elle devait
inaugurer
toutes les recherches ultérieures de l'auteur sur les Araignées, recherches qui se
sont avérées particulièrement fructueuses. André
Lopez souhaite exprimer ici une
nouvelle fois toute sa gratitude au grand zoologiste
montpelliérain qui a
initié ses succés arachnologiques en l'orientant vers cette "voie
royale", quasi inexplorée jusqu'alors (Legendre
et Lopez,1971).
 |
Les
mâles d’Araignées
possèdent des organes particuliers, propres à leur sexe, logés dans
l'épigastre,
plus précisément
dans la lèvre antérieure
du sillon (fente)
génital
(e) ou épigastrique. Les plus
visibles d’entre eux montrant un
aspect de glandes exocrines.
ils sont désignés d’après les premiers travaux de Lopez,1971
sous l’appellation
globale -reconnue ensuite
comme abusive ! -de «glandes
épigastriques».
En fait, ces organes peuvent être divisés en deux
types bien distincts.
►
Les glandes épigastriques
proprement dites ou
prégonoporales (Lopez,1977) organes
sécréteurs
pluricellulaires, acinoïdes, consistant chacune en un corps
épithélial et un canal
excréteur
allant s’ouvrir en avant du sillon
épigastrique, par une fusule
creuse implantée sur le tégument
ventral. La
présence de fusules a
été découverte
par Fage et Machado (1950)
chez les Ochyroceratidae et
confirmée ensuite par le deuxième auteur (Machado,1951), celle
des
glandes elles mêmes par
Melchers
(1964 : Theraphosidae), Marples
(1967 :
« epiandrous glands » : Gradungulidae) et Lopez (1971).
Elles
sont inconstantes et ne se rencontrent pas chez les mâles de toutes les
espèces d’Araignées (Lopez,1972 ;
Lopez,1977).
►
Les organes gonoporaux ont
été découverts et décrits chez les
Clubionidae et les Dysderidae (Lopez,1972) ,
puis dans d’autres familles. Ils sont constants et se rencontrent
pratiquement chez les mâles de toutes les espèces d’Araignées étudiées
jusqu’ici (Lopez,1977).
De
plus, étant donné qu’ils peuvent s’associer à des glandules
tégumentaires prégonoporales isolées,
du moins chez les Metinae
et les Amaurobiidae (Lopez,1986a ; Lopez,1988), l'auteur a proposé pour l’ensemble le
nom d’ «appareil
épigastrique» dans
une revue générale de la zone du gonopore
chez les
Araignées mâles (Lopez,1988).
Il s’agit là d’un complexe hétérogène, de prime abord assez incongru
puisqu’il associe des formations anatomiques dissemblables et de
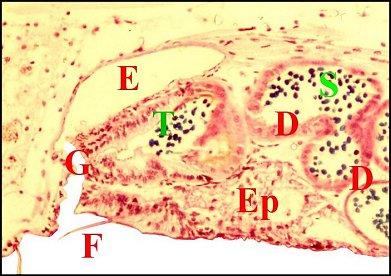
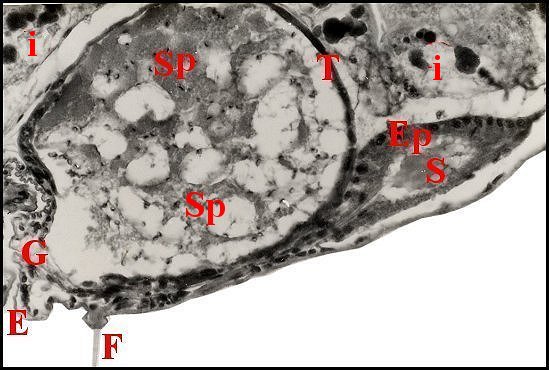
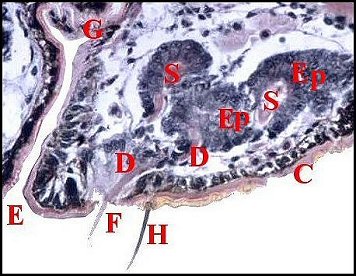
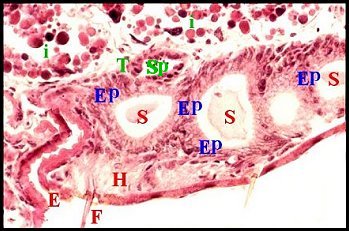
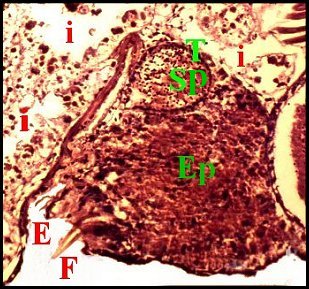
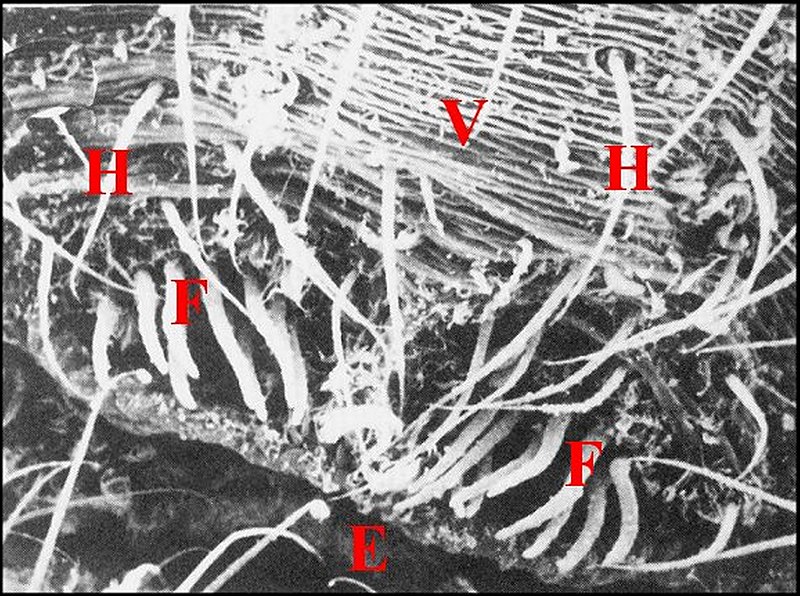
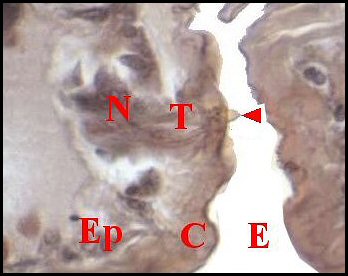
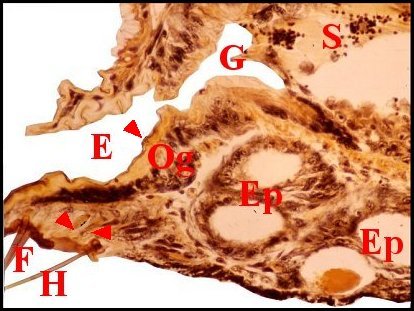
significations phylo-ontogéniques peut être différentes (Fig.1 à 3).
 |
 |
 |
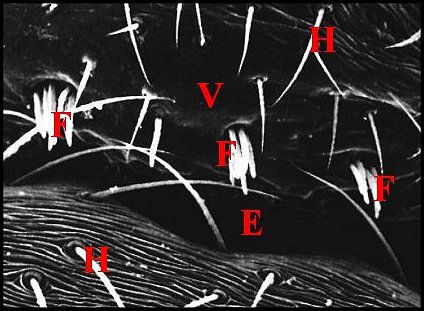
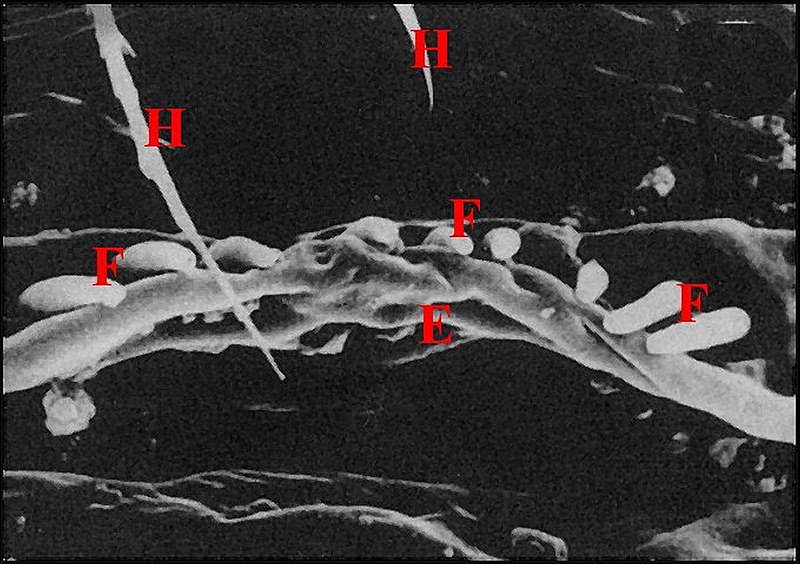
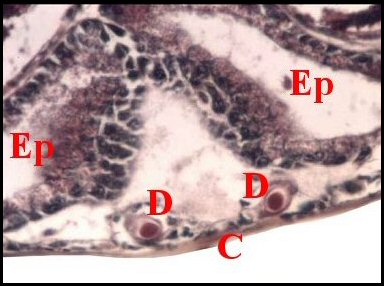
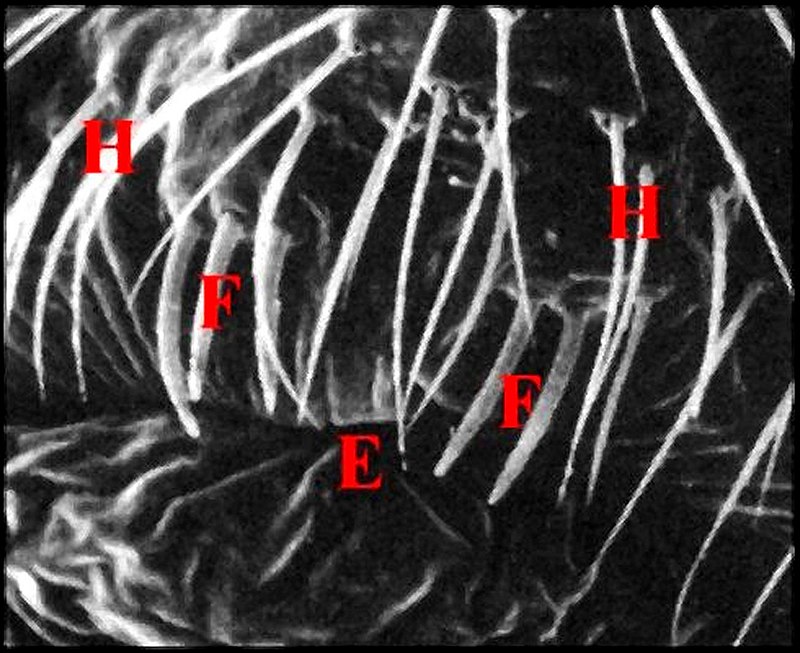
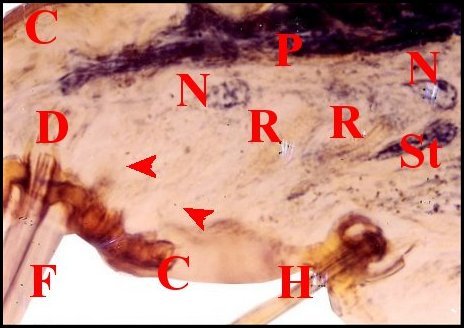
| Fig.2 - Agelena
labyrinthica mâle : région épigastrique |
Fig.3 - Argyrodes X
mâle : région épigastrique |
|
| Coupes histologiques parasagittales de
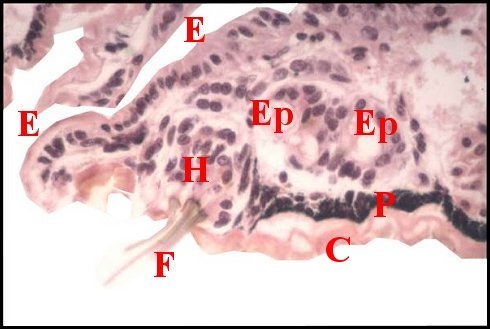
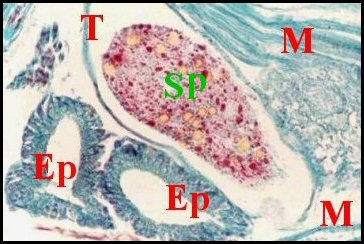
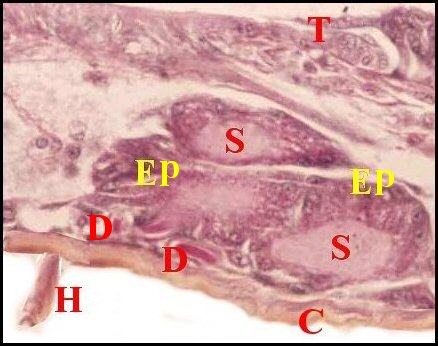
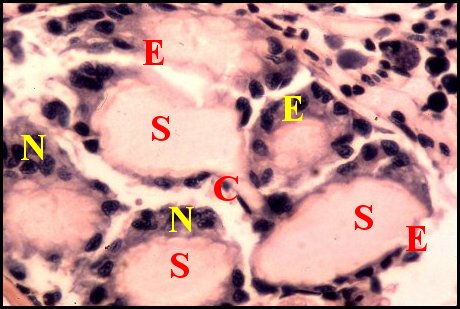
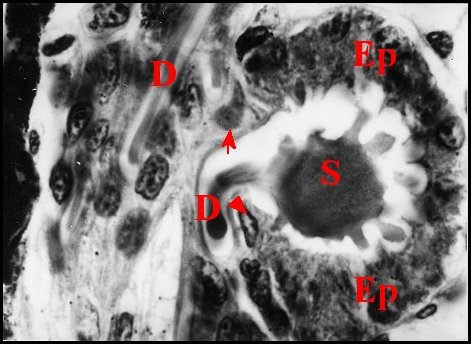
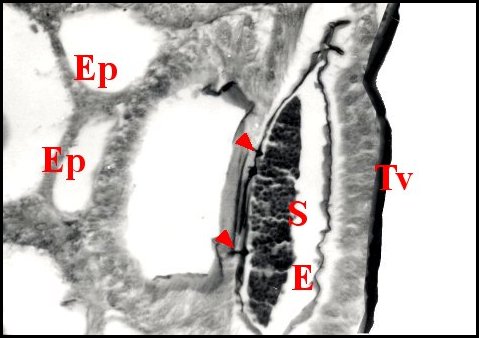
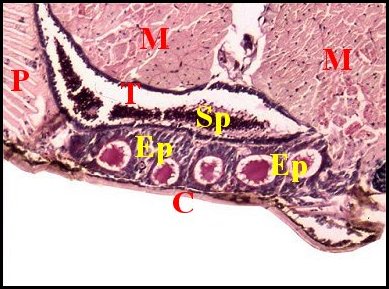
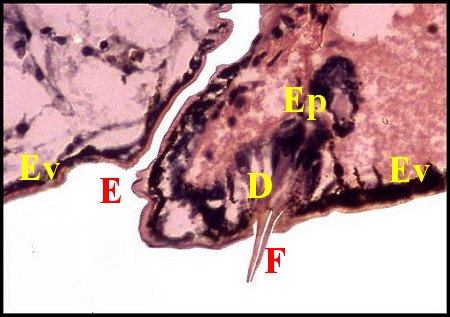
régions épigastriques et leurs appareils chez trois Araignées E, fente épigastrique - Ep, glandes épigastriques prégonoporales - F, fusule - G, gonopore - H, poil ventral - Og, organe gonoporal et sa terminaison (flèche simple) - S, spermatozoïdes dans le canal commun terminal. Flèche simple : organe gonoporal et sa terminaison. Dans la Fig.1, les 2 flèches affrontées indiquent des glandules tégumentaires prégonoporales (© A.Lopez C.H.) |
||
2 -
Glandes épigastriques ou
prégonoporales
Elles sont définies comme des organes opisthosomatiques ventraux sécréteurs pluricellulaires et acineux, situés en avant du sillon (fente) génital (e) ou épigastrique, rappelant des glandes à soie et caractéristiques des Araignées mâles.
2.a.-
Localisation et rapports
Elles occupent une position caractéristique dans la partie antérieure de l’opisthosoma (2eme segment abdominal) (Lopez,1971 ; Lopez,1977), dite région épigastrique, et y baignent dans l’ hémolymphe d’un «lac» ou sinus sanguin prismatique dont les limites se confondent avec divers organes ou tissus adjacents (Fig.1 à 3).
Sa base postérieure correspond à la fente épigastrique, dépression transversale très profonde (Fig. 1 à 3) où s’ouvre le gonopore (Fig.1,3).
Ses
limites latérales sont représentées par des fibres musculaires striées
et
par
la partie interne des deux poumons
ou phyllotrachées (Fig.
14).
Sa
limite inférieure n’est autre que le tégument
ventral, dont l’épiderme,
plus ou moins chargé
de
pigment, et la cuticule sont en continuité
avec ceux de l’invagination épigastrique.
La
limite supérieure est marquée par le canal
commun terminal
résultant de l’union des déférents
et par les diverticules
chylentériques abdominaux.
La limite antérieure correspond
généralement
aux fibres musculaires
striées
qui s’insèrent, d’une part sur le
tégument, d’autre part sur le canal commun terminal et l’endochondrite
t VIII.
Elle ne varie guère et est bâtie comme
celle d’autres organes sécréteurs aranéidiens
(glandes
venimeuses et séricigènes),
sur un
plan interne évoquant quelque peu les
acini de Vertébrés.
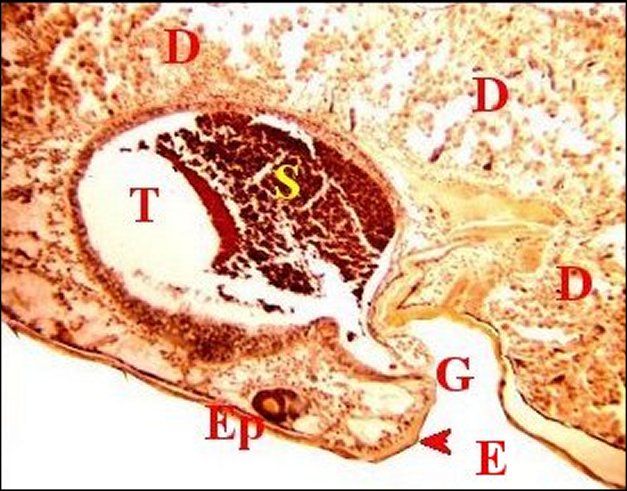
Chaque "acinus" épigastrique comporte
en effet un corps glandulaire
sacciforme, sans cellule
intermédiaire évidente(à moins qu'elle ne siège au collet : Fig.17)
et que pédiculise un canal
excréteur (Fig.6,11,12). Ce
dernier s’ouvre
extérieurement par l’intermédiaire d’une fusule canuliforme (Fig.1,2,4 à 9).
2.c.-
Corps glandulaire
2.c.1- Histologie
Le corps
est formé par un épithélium simple (Fig.5 à 15)
reposant
sur une basale et non
surmonté d’un revêtement cuticulaire.
Ses
cellules
sécrétrices (adénocytes)
prismatiques ou
pyramidales renferment des
"boules"
ou sphérules logées
dans des «vacuoles» plus
ou moins apparentes, déformant souvent le noyau et captant en général
les colorants acides tels que le bleu d’aniline (Fig.10) et l'éosine. Teintés
également en violacé par l’ hématoxyline
de Mallory (Fig.11), ces grains de
sécrétion réduisent le réactif de Schiff dans la méthode à l’APS
(Fig.12 à 15). Ils passent ensuite dans
la lumière et s’y
accumulent sous
forme d’une masse de sécrétion
plus ou moins
homogène et à contours festonnés (Fig.11,12,14 à 17).
 |
 |
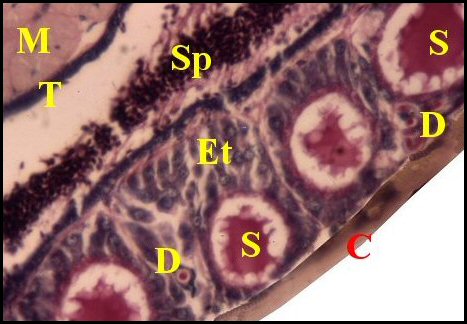 |
| Fig.13 - Pholcus phalangioides : prégonoporales |
Fig.14
- Tetragnatha extensa : prégonoporales |
Fig.15 - Tetragnatha extensa : prégonoporales,
détails |
| C, cuticule ventrale
- D, canal excréteur -Ep,
glandes prégonoporales et leur épithélium - M,
muscle
- S, sécrétion - Sp, spermatozoïdes - T, canal commun terminal Coloration APS (© A.Lopez C.H.) |
||
Il est à noter que des cellules
d'un aspect différent, sans sécrétion visible, siègent au voisinage du
collet et pourraient y être
impliquées dans la vidange glandulaire (Fig.17).
2.c.2- Ultrastructure
Elle
n’a
été qu'explorée chez les mâles de deux espèces d’ Araignées :
Pholcus phalangioides
(Lopez,1973a)
(Fig.18 à 23) et, plus succinctement, Araneus sericatus (Lopez,1977)
(Fig. 24,25).
La lumière
du corps s’insinue entre
les pôles apicaux des
adénocytes pour y former des cryptes
plus ou
moins
profondes. Elle contient un matériel
sécrétoire finement granuleux.
Chaque adénocyte est une
grosse cellule sécrétrice
prismatique
s’engrenant profondément dans ses voisines par des interdigitations que
souligne
le plasmalemme très
sinueux de ses faces latérales.
Le pôle
basal est régulier,
parfois convexe, montre un plasmalemme
ne formant pas de replis
intra-cytoplasmiques et repose sur une lame trés fine.
Le pôle apical
est garni de microvillosités
courtes, grêles, flexueuses, contenant des microfilaments axiaux,
emplissant les cryptes et plongeant dans
le matériel sécrétoire qui occupe
la
lumière (Fig.18,19,24,25).
 |
 |
 |
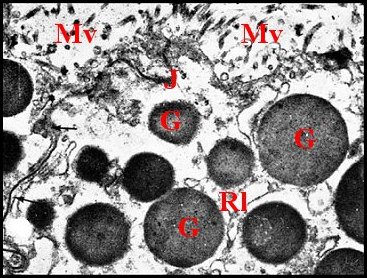
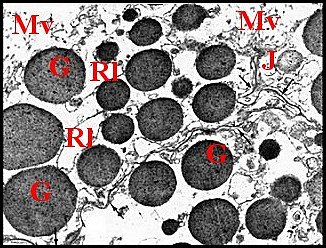
| Fig.18 - Pholcus phalangioides : adénocytes, apex |
Fig.19 - Pholcus phalangioides :
autres adénocytes |
Fig.20
- Pholcus phalangioides :
partie basale, noyau |
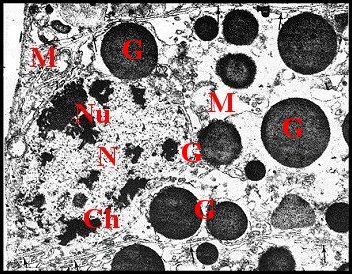
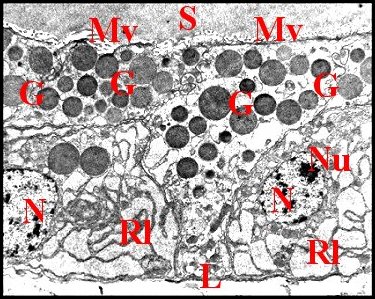
| Ch, chromatine - G, grains de sécrétion - J, jonction sub-apicale - M, mitochondrie - Mv, microvillosités - N, noyau - Nu, nucléole - Ri, réticulum. (© A.Lopez M.E.T) | ||
Le noyau, arrondi et
généralement basal
(Fig.20,21,24,25), renferme une chromatine finement
dispersée dans son nucléoplasme,
réunie aussi en mottes marginales, et
un
nucléole réticulé
excentrique. L’enveloppe
nucléaire est en
nette continuité avec le réticulum
endoplasmique
de sorte que leurs cavités peuvent communiquer largement (Fig.21
: flèches rouges)
 |
| Fig.21 - Pholcus phalangioides : noyau
et
cytoplasme d'adénocyte |
| Ch, chromatine (mottes marginales) - G,
grain de sécrétion - N, nucléoplasme - Nu, nucléole - Ri, réticulum
endoplasmique. Flèches jaunes : feuillet interne de l'enveloppe
nucléaire. Flèches rouges : communications entre l'espace
péri-nucléaire et les cavités du réticulum (© A.Lopez M.E.T) |
Ce
dernier
est remarquablement développé, en
grande partie lisse (Fig.18,19,
21,22,24,25) et
forme des cisternae
de taille très variable, s’enchevêtrant
les unes dans les autres, correspondant aux «vacuoles» de
la
microscopie optique.
Les grains de sécrétion
paraissent
y naître prés du pôle basal
dans le
réticulum endoplasmique
(Fig.22). Ils sont régulièrement sphériques, homogènes,
d’opacité variable, avec un contour très net comme tracé au compas
mais parfois un peu «décollé» de la membrane qui les
limite.
Ils
gagnent le pôle apical
de l'adénocyte ; leur
contenu y est extrudé dans la lumière (Fig.23), parfois entre les pieds des microvilli et se joint au
matériel sécrétoire qui
l’emplit.
 |
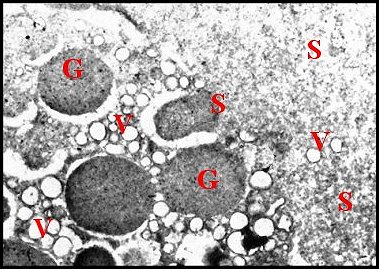 |
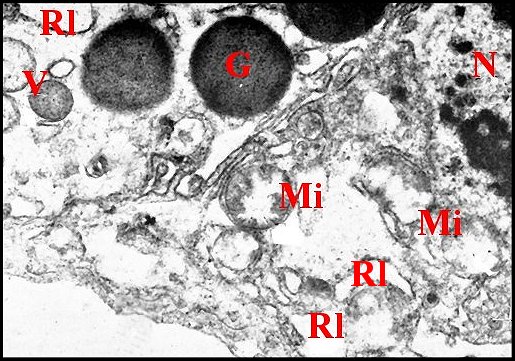
| Fig.22 - Pholcus phalangioides : autres parties basales et noyau | Fig.23 - Pholcus phalangioides : sécrétion et vésicules émises par les apex |
| G, grains de sécrétion - Mi, mitochondrie -N, noyau - Ri, réticulum - S, sécrétion -V, vésicule (© A.Lopez M.E.T) | |
 |
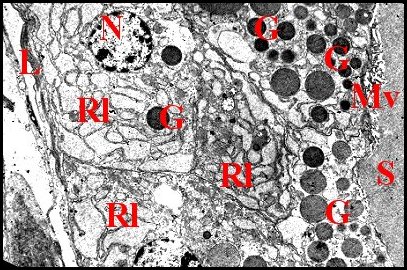 |
| Fig.24 - Araneus sericatus : paroi de glande prégonoporale et ses adénocytes | Fig.25 - Araneus sericatus : Paroi de glande prégonoporale et autres adénocytes |
| G, grains de sécrétion - L, lame basale - Mv, microvillosités apicales - N; noyau - Nu, nucléole - Ri, réticulum endoplasmique - S, sécrétion (© A.Lopez M.E.T) | |
Les autres organites
sub-cellulaires
sont de petites mitochondries
sphériques
(Fig.22), à crêtes
estompées, à matrix très
claire, siégeant surtout près du
noyau dans
le pôle basal et de
petites vésicules
apicales. Ces
dernières paraissent vides mais ont une membrane trés contrastée
(vésicules recouvertes)
et sont parfois libérées dans la lumière avec le contenu des
grains (Fig.23). Bien
qu’il n’ait
pas été observé de dictyosomes individualisés,
elles pourraient avoir une origine golgienne.
La cohésion des
adénocytes est assurée par de
petites jonctions
sub-apicales (desmosomes zonaires)
(Fig.18,19).
Etabli
d’après celui de leurs fusules
brisées et intactes,
le nombre des corps
glandulaires est réduit chez certaines Argyrodes (2 ou 3) et
les Pholcidae (4 à 5), plus
important
chez certaines Araneidae
(Gasteracantha, 6 à
8 ; Nemoscolus,
10 ; Cyrtophora, 15) et
les Theridions (8 à 13), moyen chez Argiope (20) et
Nephila, pouvant
enfin atteindre la trentaine chez d’autres Araneidae.
Les chiffres les plus élevés semblent caractériser Eresus
niger ( Fig.8, 52 ) et les Mygalomorphes où
Legendre(1972) a pu
dénombrer , chez Scodra calceata (Stromatopelma
calceatum) de 150 à 200 fusules.
Le corps glandulaire
est
généralement sphéroïdal ou piriforme, donc acineux. Il peut aussi
s’allonger en un sac tronconique régulier (aspect tubulo-acineux d’Eresus
niger : Fig.8) ou de
forme ovoïde (Pholcidae :
Fig.10).
Chez Amaurobius erberi, le corps glandulaire paraît inhabituellement très petit dans les coupes histologiques et comme «sous-développé».
Les grains
de sécrétion ont un
aspect
uniforme dans la grande majorité des familles. Toutefois,
chez
Pisaura
mirabilis et surtout
certains Linyphiidae tels que
Pityohyphantes
phrygianus,
ils se répartissent en deux lots conférant un net
aspect mi-partie (selon un terme
de Millot pour les glandes à soie) au corps de
la glande : un lot supérieur ou distal dont les grains
sont plus volumineux
(diamètre 3 à 4 µ) et captent fortement l’éosine, donc
acidophiles ; un lot
inférieur, proximal ou juxta-canalaire
dont les «boules» sont plus petites (2 µm) et se colorent
en
noir-bleuté par l’hématoxyline, donc basophiles, au point de se
confondre
avec le pigment mélanique de
l’épiderme ventral sous-jacent (Fig.26) ).
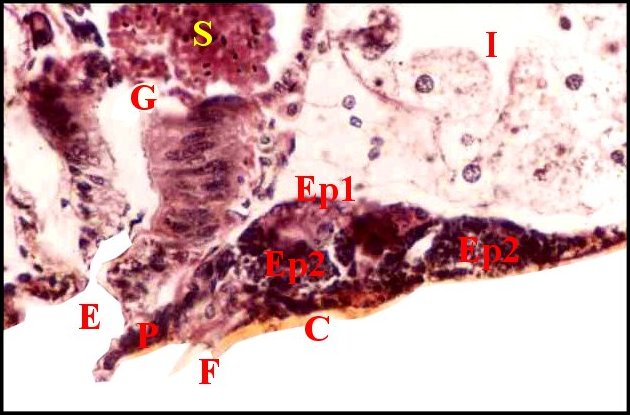 |
| Fig.26 - Pityohyphantes phrygianus, mâle : région épigastrique avec les glandes prégonoporales mi-parties |
| C, cuticule ventrale - E, fente épigastrique - Ep1, Ep2, régions distale et proximale des glandes prégonoporales - F, fusule - G, gonopore - P, épiderme ventral pigmenté - S, spermatozoïdes (© A.Lopez C.H.) |
2.c.3.c-
V.volumétriques
Les dimensions
les plus importantes se rencontrent chez Eresus niger dont les
tubulo-acini mesurent 480
µm
de long, pour une largeur de 120, sont bourrés de grains
acidophiles
et se groupent en un massif cuneiforme dense,
long de 1 mm chez
un mâle de 1,5 cm (Fig.8).
Dans
la familles des Pholcidae, la longueur varie
de 150 µ (Pholcus) à 230 (Smeringopus) pour une largeur
moyenne de 80.
Les
dimensions les plus modestes sont observées chez les Theridiidae dont
le diamètre
acineux n’excède pas 40 µm pour une épaisseur épithéliale 4 fois
moindre.
Chez le
Pholcide
Holocnemus pluchei, l'auteur a détecté la présence
remarquable, jusqu'ici unique, de cellules
pigmentées rameuses (Lopez,1973c), aussi-bien
dans le céphalothorax
(Fig.27) que dans l'abdomen
où ces chromatophores
entourent chaque acinus
épigastrique, lui formant
un «manteau» caractéristique et soulignant ses contours (Fig.28).
 |
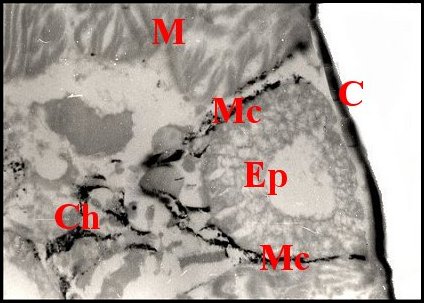 |
| Fig.27 - Holocnemus pluchei : chromatophores dans le tissu réticulé du céphalothorax. | Fig.28 -Holocnemus pluchei : chromatophores entourant un acinus épigastrique |
| C, cuticule ventrale - Ch, chromatophores - Ep, acinus prégonoporal - M, muscle - Mc, "manteau" de chromatophores - P, épiderme pigmenté - R, tissu réticulé (© A.Lopez C.H.) | |
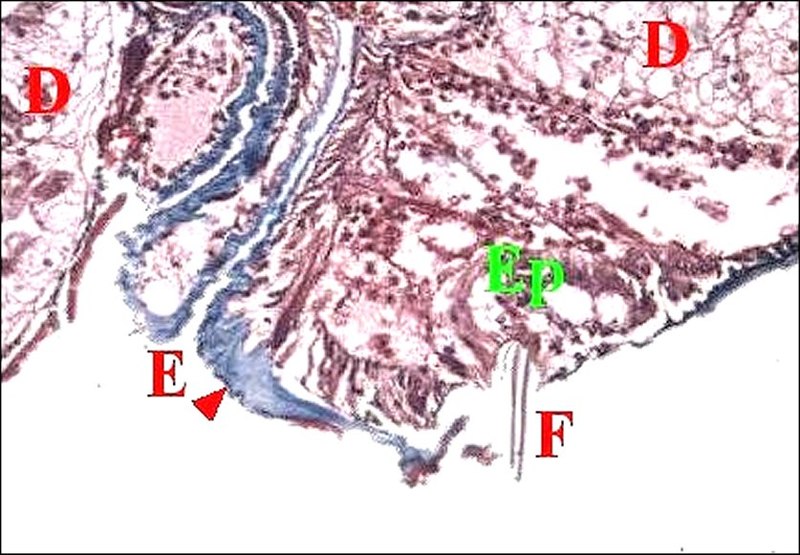
Chaque canal
se présente
comme un
fin conduit éosinophile (Fig.6,11,12,13,15,17), de calibre
assez constant mais de longueur variable, rectiligne ou pelotonné sur
lui-même, et entouré par au moins une cellule satellite
dont le noyau dense, trés
chromatique,
est seul bien visible, surtout au voisinage du collet.
Juste
avant d’aboutir à sa fusule,
le canal traverse
généralement
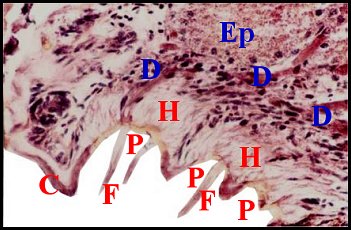
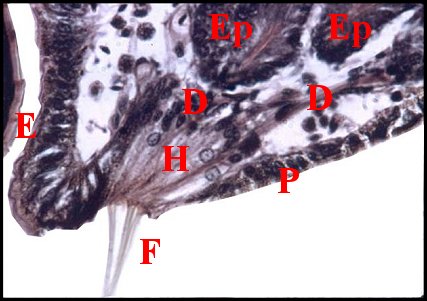
un épiderme modifié (Fig.4,6,7,9,29,30)
que
Marples
(1967) décrivit pour
la première fois chez
Hickmania dans une étude histologique
rudimentaire. Cet épithélium,
plus ou moins
concave, déprimé en «cupule» ou «puits» (« pit »), est formé
par des cellules
prismatiques hautes, à noyaux
basaux, à cytoplasmes
clairs, d’aspect «fibrillaire» (Fig.29,30), pouvant renfermer des
grains de pigment mélanique et
est
surmonté
par un revêtement cuticulaire
strié.
Chaque canal
est formé par une cuticule
d’abord striée puis
homogène, qu’entourent des cellules
satellites ou canalaires
remarquables par une disposition complexe de leurs membranes.
La cuticule
paraît se délaminer
peu avant sa terminaison.
Le pôle
apical de chaque cellule
canalaire est uni à celui
des voisines par des jonctions
zonaires
et compartimenté par de profondes invaginations
de son plasmalemme en
microvillosités
nombreuses et parallèles (Fig.31). Ces microvilli montrent des
densifications apicales et
sont séparées de la cuticule
par un espace
extracellulaire. Des vésicules
d’endocytose sont
visibles entre leurs pieds.
 |
| Fig.31-
Araneus sericatus : canal excréteur . |
| C, cuticule - J, jonction - S, sécrétion - V, microvilli. (© A.Lopez M.E.T) |
2.e.- Fusules épigastriques
Dans les coupes histologiques, à la loupe binoculaire et surtout au M.E.B (Lopez,1988), les fusules se présentent comme des structures de forme assez constante mais de disposition plus variable. Leur compte permet évidemment celui des corps acineux, donc des glandes prégonoporales, souvent difficile et parfois impossible dans les coupes histologiques lorsqu’elles y sont trop nombreuses.
De
prime abord, les fusules
épigastriques évoquent celles des filières de glandes
séricigènes (Fig.
32)
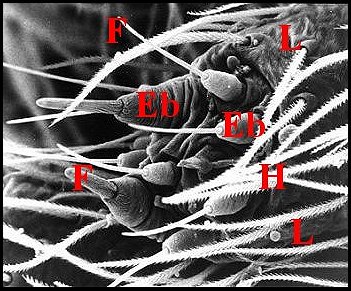 |
| Fig.32 - Hahnia sp. : fusules sur une filière antérieure. |
| Eb, embase - F, fusule - H, poils - L, filière (© A.Lopez M.E.B) |
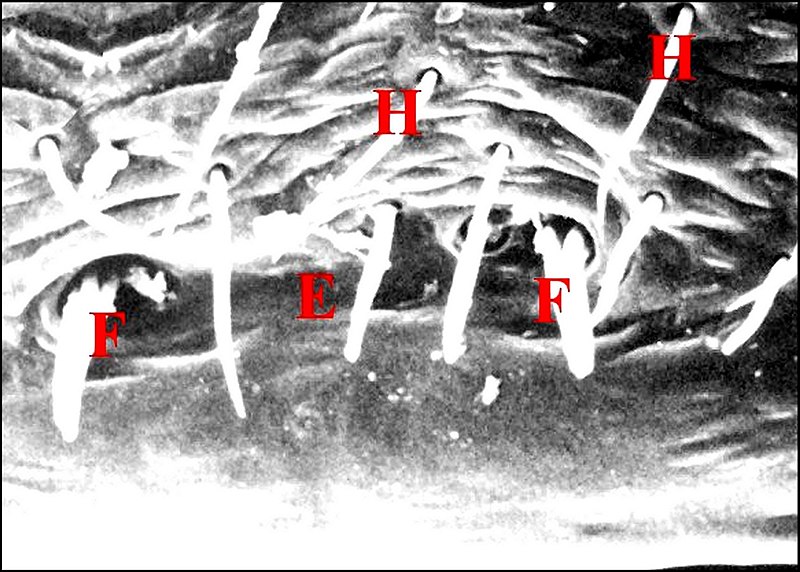
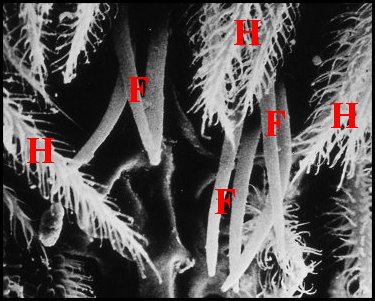
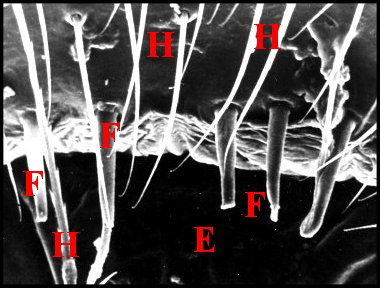
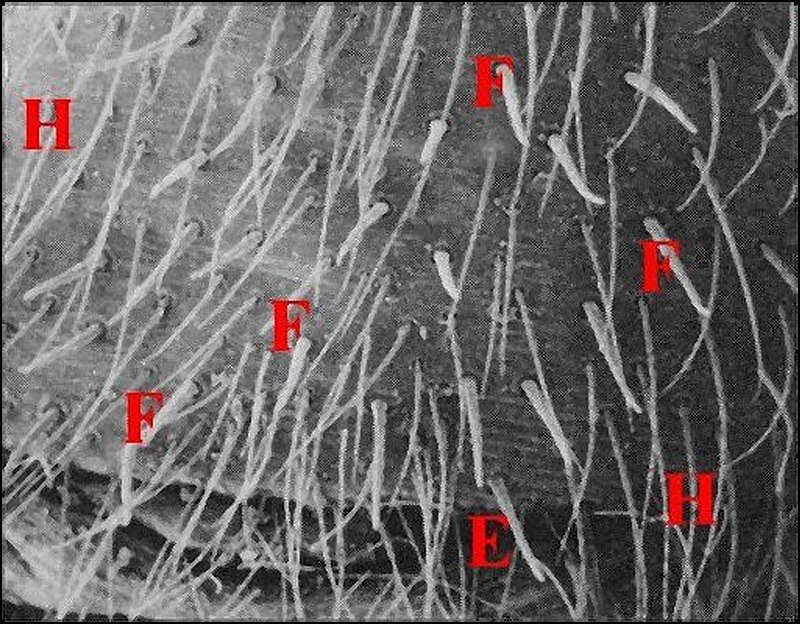
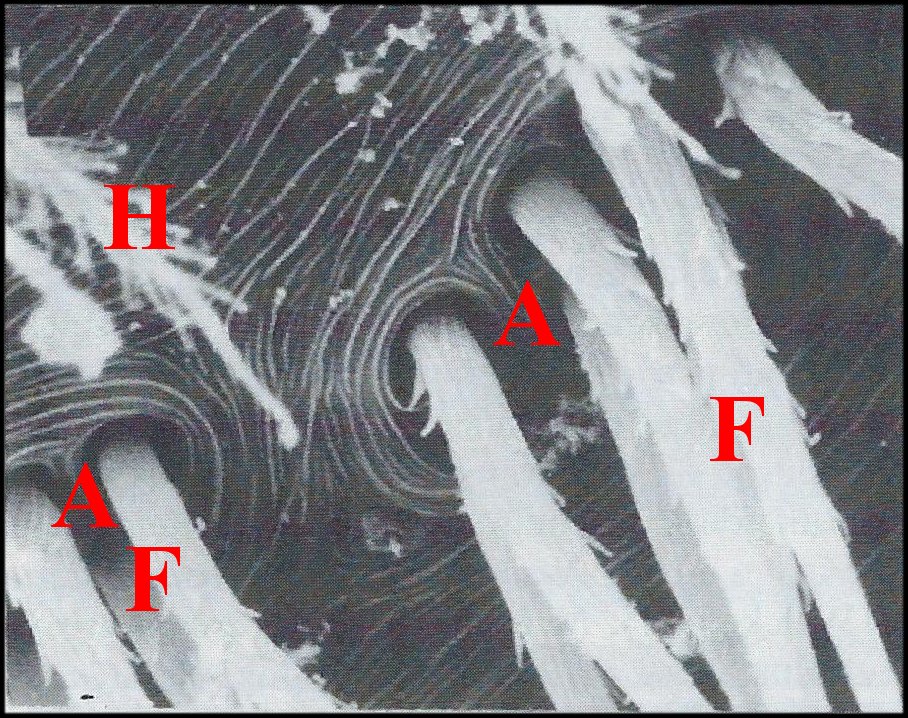
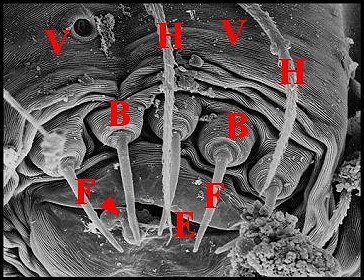
Elles peuvent être coniques, courtes et tronquées (Pholcus phalangioides) (Fig.33) ou, plus souvent, grêles et effilées, longues de 40 à 70 µm pour un diamètre basal de 10 maximum.
Elles sont alors
∙presque droites dans les genres Nemesia (Ctenizidae) (Fig.34), Holocnemus (Pholcidae)(Fig.35), Argiope (Araneidae)(Fig.36), Micrathena (Araneidae) (Fig.37) et Philoponella (Uloboridae), de Guyane (Fig. 38)
∙plus ou moins arquées chez Scytodes (Scytodidae)(Fig.48), Nesticus (Nesticidae) (Fig. 49) et Araniella (Araneidae) (Fig.52)
∙un peu
«tordues» dans les genres Leptoneta (Leptonetidae)(fig.43) et Saitis (Salticidae)(Fig.54).
 |
 |
 |
| Fig.34 - Nemesia
caementaria : région épigastrique. Ensemble |
Fig.35 - Holocnemus
pluchei : région épigastrique. |
|
|
E, fente épigastrique - F, fusules - H, poils
(© A.Lopez M.E.B)
|
||
Les
fusules épigastriques ne sont
pas lisses dans l’ensemble mais un peu striées-cannelées suivant la
longueur. Amaurobius
erberi (Amaurobiidae)
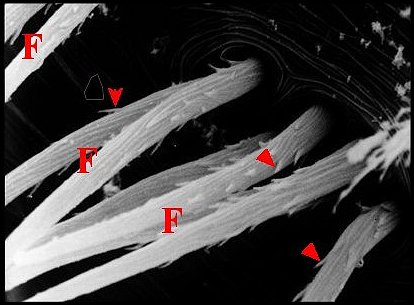
représente le seul cas où leur surface soit garnie de spinules (Fig.
39,40).
 |
 |
| Fig.39 - Amaurobius erberi : deux groupes de fusules | Fig.40 - Amaurobius erberi : autres fusules, détails |
| A, alvéoles -
F, fusules - H, poil. Flèches : spinules (© A.Lopez M.E.B) Scan photo 3,
1988. |
|
Le point de jonction de
la fusule avec le tégument ventral montre
une
grande diversité d’aspects
surtout visible en M.E.B.
Il peut être :
. de niveau avec une surface
tégumentaire plane dont la fusule
fait directement saillie : Nemesia
caementaria (Fig. 34) et Atypus
affinis (Fig.
47) (Mygalomorphae),
Anelosimus
eximius, de Guyane (Theridiidae)
(Fig41).
. sur un léger relief en
"coussin" : Filistata
insidiatrix (Filistatidae).
. enfoncé dans une alvéole arrondie de
sorte qu’il apparaît
entouré d’un sillon circulaire, simple (Amaurobius
: Amaurobiidae) (Fig.
39) ou lui-même encerclé par un relief cupuliforme plus ou moins
saillant, soit lisse (Salticus
scenicus
: Fig. 42 ;
Pholcus phalangioides
: Fig. 33), soit décoré de crêtes
concentriques trés nettes (Leptoneta
infuscata
minos : Fig. 43).
De plus, la
base des fusules
épigastriques ne montre
pas un profil modifié (Lopez,1988),
alors que celle des fusules
de glandes séricigènes
est caractérisée par un élargissement bulbeux ou en cône (Fig. 32). Les
Ochyroceratidae font
toutefois exception car leurs fusules
épigastriques ont une embase
élargie remarquable au-dessus de laquelle chaque fût s'effile
progressivement (Lopez,1980
: Ochyrocera
peruana ; Lopez,1985 : Ochyrocera
thibaudi, de Guadeloupe ; Lopez,1997 :
Ochyrocera
caeruleoamethystina, de Guyane)
(Fig. 44 à 46).
 |
 |
|
| Fig.44 - Ochyrocera peruana: lèvre
antérieure, fusule |
Fig.45- Ochyrocera thibaudi Lopez : fusules. |
Fig.46 - Ochyrocera caeruleo-amethystina Lopez: fusules |
|
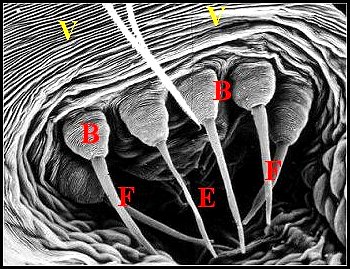
C, cuticule - E, fente épigastrique - F, fusule et son embase (Eb ou B) - Ep, corps de glande prégonoporale - H, poil - V, face ventrale de l'épigastre en avant des fusules.Flèche (Fig.45): cordon spermatique sortant de la fente (© A.Lopez C.H. Fig.44 et M.E.B. Fig.45,46) |
||
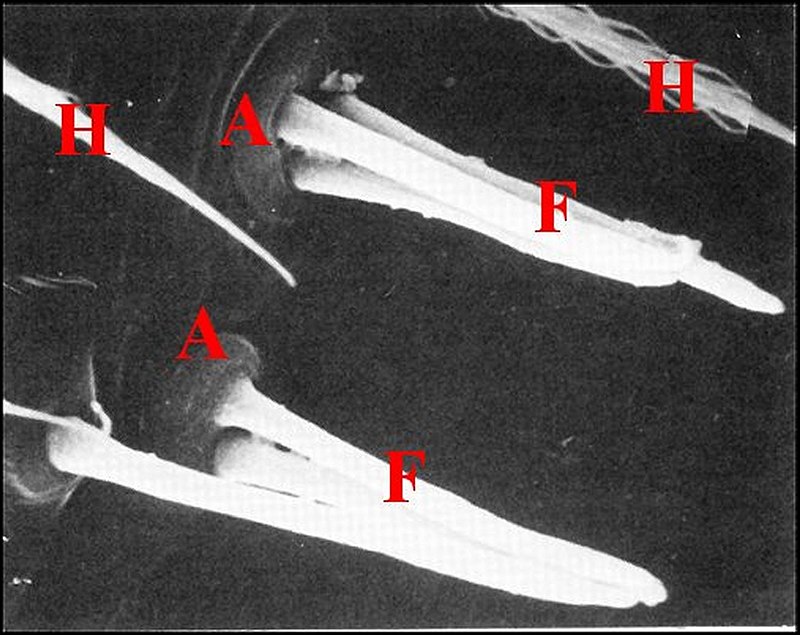
De
même, chez les Tetragnathidae Tetragnatha
extensa et Pachygnatha
clercki, chaque
fusule possède une embase
cylindrique à sommet tubulaire que prolonge le fût (Fig. 55).
La
disposition des fusules,
que l'on peut qualifier de "fusulotaxie" (réemployant ainsi un
"suffixe" parfois accolé au nom de
certains poils
sensoriels,
les trichobothries =
"trichobothriotaxie") est très
variable suivant
les groupes et atteint son maximum d'originalité dans le cas des
Tetragnathidae.
Chez les
Mygalomorphae, telles que Nemesia
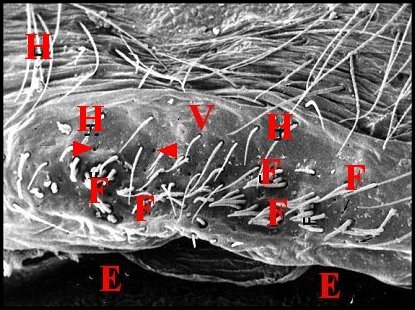
caementaria (Fig.34) et Atypus
affinis
(Fig. 47), les fusules
sont très nombreuses, solitaires et disposées sans ordre sur presque
toute l’étendue de l’aire
épigastrique.
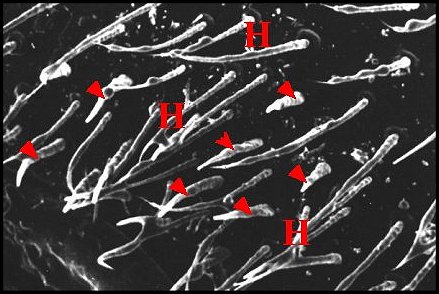 |
| Fig. 47- Atypus affinis : région épigastrique. |
| H, poils. Flèches : fusules disposées sans ordre (© A.Lopez M.E.B) |
Chez les Araneomorphae,
elles peuvent être
•isolées, peu nombreuses
et sur une seule file : 5 dans le genre Ochyrocera (Ochyroceratidae) (Fig.
44 à 46), 9 chez Scytodes
thoracica (Scytodidae)
(Fig.48).
∙plus nombreuses (13 à
14) et tendant à se disposer sur deux files chez Nesticus cellulanus
(Nesticidae) (Fig.
49).
∙ peu nombreuses mais
ayant tendance à se réunir en deux groupes : Pholcidae dont Pholcus
phalangioides (Fig. 33)
et surtout Holocnemus pluchei
(Fig. 35), où
5 fusules évoluent vers
un rapprochement par 3 et 2.
∙nombreuses et réunies en plusieurs
petits groupes inégaux de disposition irrégulière chez les
Metinae Meta
bourneti et M. menardi
(Fig.50) (Lopez,1986a ; Lopez,1988).
∙nombreuses mais formant de petits groupes
régulièrement espacés sur une ligne transversale dans le cas d’
Araignées aussi diverses que
les
Araneidae, tels qu'Argiope
argentata (Fig.51),
belle espèce néotropicale à grand
dimorphisme sexuel comme l' Argiope
lobée de nos garrigues, Araniella
cucurbitina (Fig.52), les genres Nephila et Gasteracantha, les Linyphiidae
(Linyphia, Florinda), les Gnaphosidae (Drassodes lapidosus)
(Fig.53), les Agelenidae (Tegenaria), les Uloboridae (Philoponella)
(Fig.38) et les Eusparassidae (Micrommata)
(Lopez,1988).
∙réunies cette fois en deux «touffes» ou «pinceaux», bien distinctes et symétriques chez les Theridiidae Argyrodes cognatus, Anelosimus eximius (Fig.41) araignée coloniale de Guyane, ainsi que chez Leptoneta infuscata minos (Leptonetidae) (Fig.43), Saitis barbipes (Salticidae) (Fig.54) et surtout, Tetragnatha extensa (Fig.55) et Pachygnatha clercki (Tetragnathidae) (Lopez,1988).
Les fusules groupées peuvent
se loger dans des dépressions communes arrondies ou oblongues et de
profondeur variable : les
«puits» ("pits" en
anglais).
Leur rebord ou margelle,
mousse ou un peu aigu, surplombe le tégument
voisin.
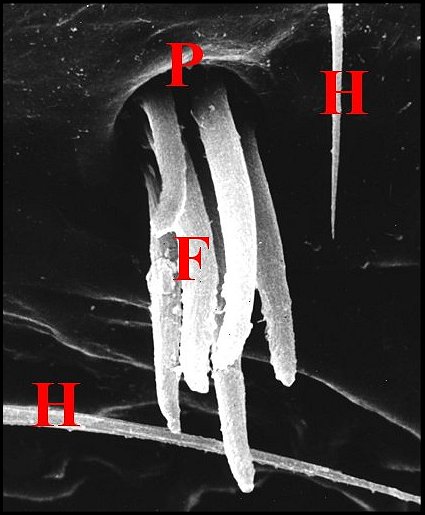
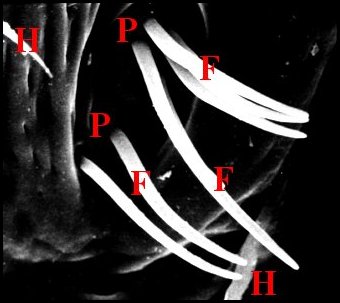
Déjà visibles dans les coupes histologiques où leur dépression cuticulaire surmonte l' épiderme modifié entourant la terminaison des canaux excréteurs (Fig.29,30,56,58), ils apparaissent surtout au M.E.B. chez Argiope argentata (Fig.59), Araniella cucurbitina (Fig.60), Saitis barbipes (Salticidae) (Fig.54), Eresus niger (Eresidae) (Fig.61) et tout particulièrement, dans l’intéressante famille des Tetragnathidae. Tetragnatha extensa (Fig.55) et Pachygnatha clercki possèdent deux dépressions symétriques séparées par une crête.
 |
 |
 |
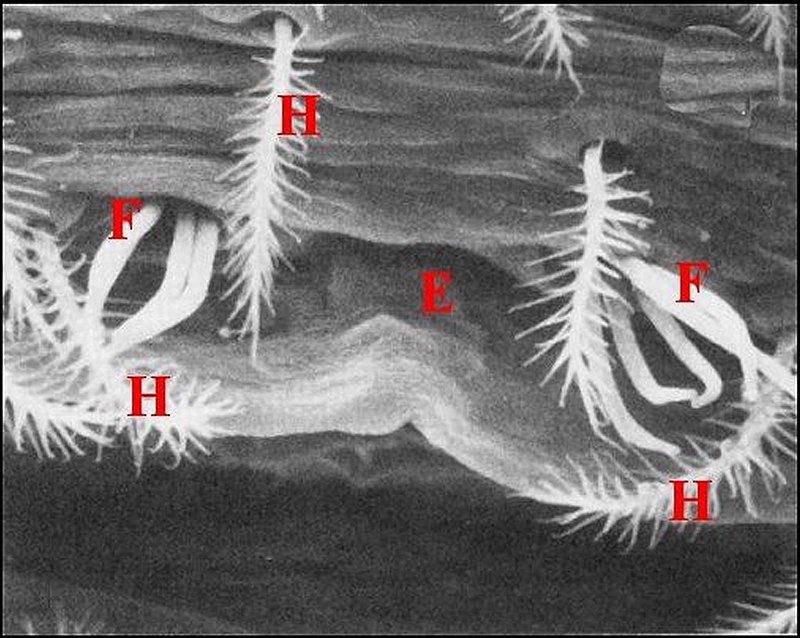
| Fig. 56 - Agelena
labyrinthica : puits et fusules |
Fig. 57 - Argiope bruennichi :
puits et fusules |
Fig.58 - Argiope
bruennichi : puits et fusules, détail |
|
C,
cuticule ventrale - D, canaux excréteurs - E, fente épigastrique
- Ep, glandes prégonoporales et leur épithélium - Ev, épiderme ventral
- F, fusules - H, épiderme modifié sous le puits. Flèches : dépression
cuticulaire du puits (© A.Lopez C.H.)
|
||
 |
 |
 |
| Fig. 59 - Argiope argentata : groupe de fusules et "puits" | Fig.60 - Araniella cucurbitina : groupe de fusules et "puits" |
Fig.61
- Eresus
niger : groupes de fusules
déjà présentées en C.H. . Fig.29. |
| E, fente épigastrique - F, fusules - H, poil - P, puits et leur margelle (© A.Lopez M.E.B) | ||
 |
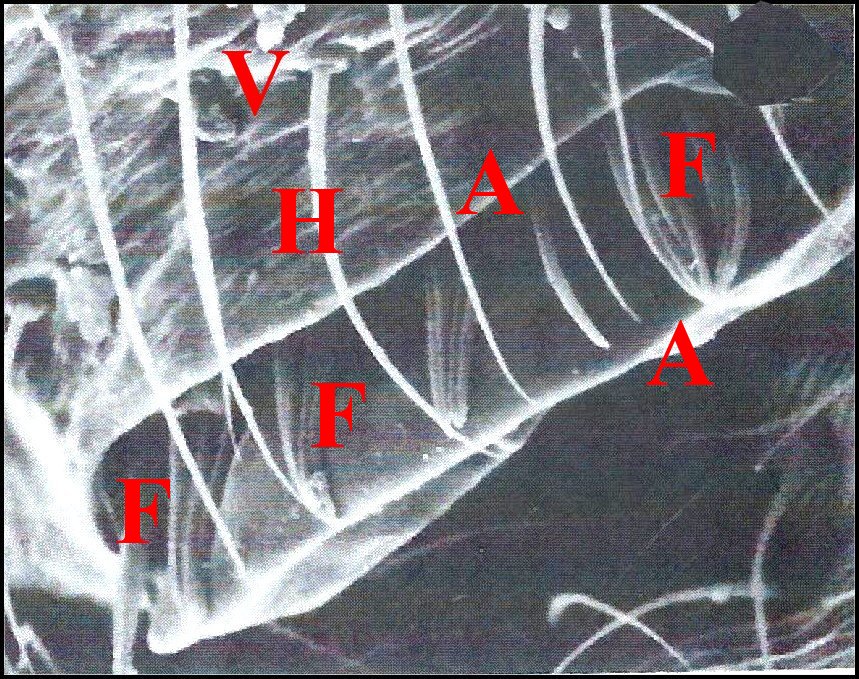 |
| Fig. 62 - Leucauge argyra : région épigastrique, vue globale. | Fig.63
- Leucauge argyra : le "puits" en
"auge". |
| A,
margelle du "puits" en "auge"- E, fente épigastrique et sa lèvre
antérieure L - F, fusules - H, poils - V,
face ventrale de l'épigastre. Flèches : orifices de glandules tégumentaires (© A.Lopez M.E.B) Fig.63 : scan photo 16, 1988. |
|
Les coupes histologiques (Fig.1,4,5,6,7,8,9)
montrent surtout que chaque fusule
est creuse
et
traversée sur toute sa longueur par le canal excréteur de la glande
prégonoporale
correspondante. Ce canal
s’ouvre à l’extrémité libre de la fusule par un pore qui peut être
éversé.
3 - Organes gonoporaux (ex
"glandes
gonoporales)
3.a.- Localisation et rapports
Ils occupent une
position très voisine de
celle des glandes prégonoporales
dans la partie antérieure de l’abdomen
ou opisthosoma et y
baignent aussi dans l’ hémolymphe du même
«lac» ou sinus sanguin
(Fig.
1).
Leur aspect microscopique et l’absence
de sécrétion
permettent aujourd’hui d’en affirmer la nature nerveuse et sensorielle
que l'auteur a découverte tardivement dans des photos de sa thèse au M.E.T (Fig.64).
3.b.-Histologie
Les cellules
constitutives ne se
groupent plus en acini.
Elles sont isolées les unes des autres
dans le mode «dispersé» (Lopez,1972
: Segestriidae, Dysderidae ; Lopez,1974a
; Lopez,1974b
: Pholcidae)
(Fig. ) ou réunies en deux massifs symétriques
plus ou
moins compacts dans le mode
«agminé»
(Lopez,1972 ; Lopez,1973b
; Lopez,1974a ; Lopez,1974b
; Lopez,1976),
notamment chez les Miturgidae et les
Argyronetidae.
Leur cytoplasme
est peu visible,
exigu, et sans grains de sécrétion individualisés. Deux d’entre elles,
les neurones, ont un
noyau arrondi, clair et
vésiculeux ; les autres sont des cellules
«satellites» ou
«enveloppes», plus
petites, à noyau
allongé, ovoïde, riche en
chromatine.
Il s’en détache
une structure spéciale que l'auteur avait initialement
considérée à tort comme
un canalicule excréteur individuel (Lopez,1972)
mais qui est
en
fait une gaine cuticulaire
entourant des dendrites
de neurones. Elle
présente l’aspect d’un tubule «chitinoïde», coloré par l’éosine et le
vert lumière, non par l’
APS, de section arrondie, grêle, très exigu (1 µm) délié, plus ou moins
long (10 à 20 µm), rectiligne ou coudé.
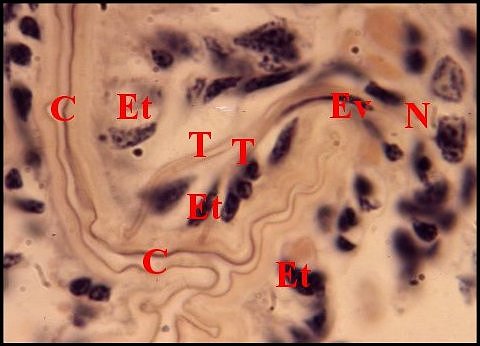
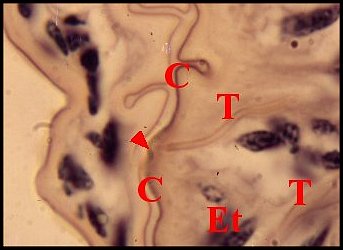
Chez les Dysderidae et
les Segestriidae
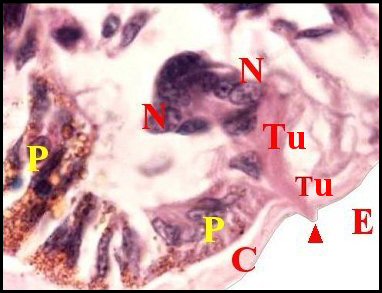
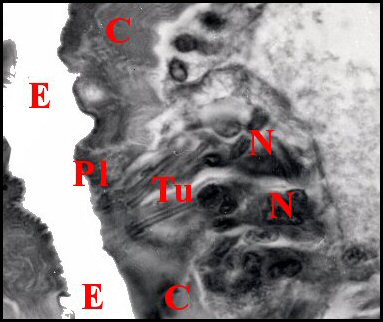
(Fig .64 à 66), les organes
gonoporaux, au nombre très approximatif d’une cinquantaine, s’éparpillent sur le mode «dispersé». Leurs
gaines cuticulaires, souvent
longues de 20 µm, peuvent présenter des dilatations ampullaires, se
lover en boucle et aboutissent,
indépendamment les unes des autres, dans le canal commun terminal dont
elles traversent l’épithélium
en se raccordant à son revêtement
chitineux. Elles s’y terminent par
une petite
saillie acuminée, la «papille»,
logée parfois dans une dépression
cuticulaire
en entonnoir, l’ «infundibulum» (Lopez,1972) (Fig.66).
 |
 |
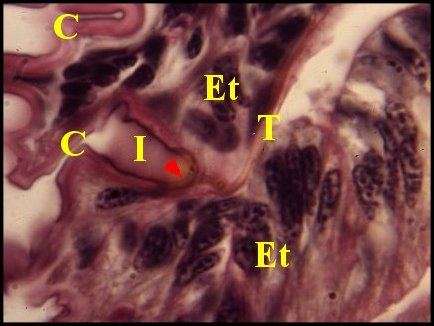 |
| Fig.64- Segestria
florentina : organes
gonoporaux |
Fig.65 - Organes gonoporaux,
détail : papille |
Fig. 66 Organes gonoporaux,
autre détail : infundibulum |
| C, canal commun
terminal
et sa cuticule - Et, son épithélium - Ev, cellule-enveloppe - I,
infundibulum - N, noyaux - T, gaine cuticulaire en "tubule".
Flèches : papilles (© A.Lopez C.H.) |
||
Les organes
gonoporaux des Pholcidae
sont beaucoup moins
nombreux (Fig. 67), plus superficiels
et pourvus d’une gaine
cuticulaire se terminant par une papille en
« bouton » argyrophile
non pas dans le canal commun
terminal mais
dans la fente épigastrique
elle même.
Les
organes gonoporaux des autres
Araignées,
Miturgidae en particulier
(Fig. 59) sont pairs et "agminés" en deux groupes compacts symétriques,
toujours plus superficielque ceux des Dysderidae et des Segestriidae. Leurs gaines cuticulaires groupées
constituent un faisceau court et dense
(Fig.59 à 60) et traversent la cuticule
de la fente épigastrique,
épaissie à ce
niveau en une plaque
d’affinité tinctoriale modifiée et portant en
surface
une ou plusieurs «papilles»
saillantes (Fig. 59,61).
3.c.-Microscopie
électronique
La
zone de terminaison présumée des organes
gonoporaux ne révèle pas au M.E.B. l’existence d’ orifices
excréteurs. Ces pores
auraient été les seuls indicateurs de glandes
sous-jacentes.
Elle
montre seulement deux champs symétriques portant une ou plusieurs
saillies correspondant aux «papilles»
de la microscopie optique, en forme de mamelon plus ou moins conique,
mousse ou acuminé (Fig.63). La surface de ces projections est lisse et
imperforée dans sa totalité. Elles sont
surtout bien visibles dans le cas des Lycosidae (Fig.62,63) où leur
siège inhabituellement superficiel les rend beaucoup plus accessibles
que chez les autres Araignées.
Les terminaisons profondes caractérisant le mode «dispersé» (Pholcidae,
Dysderidae, Segestriidae) échappent
d’ailleurs
totalement au M.E.B.
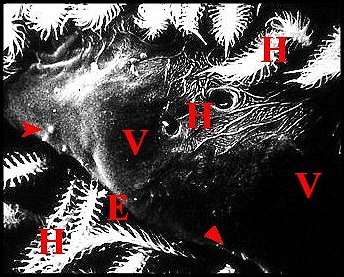 |
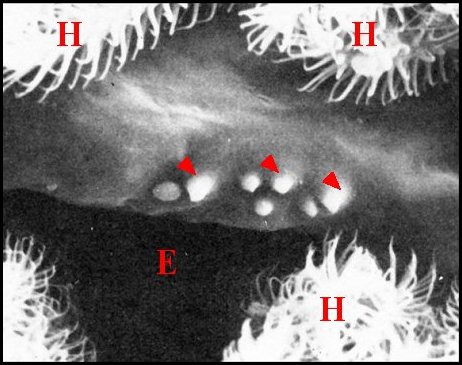 |
| Fig.62- Pardosa hortensis : champs
gonoporaux |
Fig.63- Alopecosa fabrilis : champ gonoporal |
| E, fente épigastrique
- H, poils plumeux - V, face ventrale de l'épigastre. Les flèches
désignent
les champs
gonoporaux et
leurs papilles (© A.Lopez M.E.B) |
|
Il est à noter que
le tégument
entourant les champs
épigastriques gonoporaux ne porte que des poils tactiles, simples ou
plumeux.
Au
M.E.T, certaines images revues ultérieurement (Cheiracanthium punctorium :
Miturgidae) (Fig.64)
rappellent sans aucun doute celles du stato-récepteur
pédiculaire
(le prétendu «appareil
stridulatoire ») des Argyrodes.
Chaque organe gonoporal est une unité anatomo-fonctionnelle constituée par 2 neurones bipolaires, 3 cellules enveloppes, la gaine cuticulaire et un capteur externe correspondant à la «papille» ou «mamelon».
Le corps cellulaire des neurones renferme un noyau arrondi, régulier, nucléolé, à chromatine surtout marginale, des mitochondries, un appareil de Golgi (dictyosomes) et du réticulum.
Le prolongement axonique n’a été qu’entrevu. Les dendrites des deux neurones de chaque unité renferment des neurotubules longitudinaux. D’après certains documents photographiques dont l'auteur a perdu la trace dans un laboratoire de l'INRA (St Christol les Alès), ils semblaient comporter aussi des centrioles et un corps tubulaire n’existant peut être que dans un seul d’entre eux.
Ces
dendrites, accolés en
couple, sont entourés par la gaine
cuticulaire, très osmiophile, nette
à leur contact, mal limitée extérieurement et allant rejoindre la papille pour s’y insérer
(Fig.64).
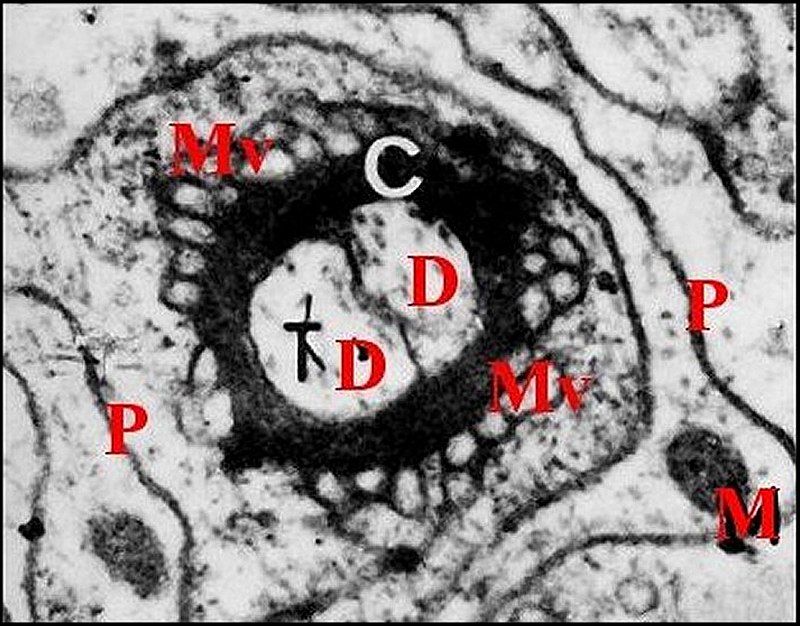
|
| Fig.64
-Cheiracanthium
punctorium : coupe
transversale d'un couple de dendrites.
|
| D,
dendrites ; C, gaine cuticulaire ; M, mitochondrie ; Mv,
micvrovillosités ; P, plasmalemme de cellules-enveloppes ; T, neurotubules (© A.Lopez M.E.T) d'après 1977, planche IV |
Les
trois cellules enveloppes
(Fig.64) sont allongées, aplaties, enroulées sur elles-mêmes en
manchons, forment ainsi des mésos,
s’accolent
aux neurones, entourent
les
dendrites
et leur gaine cuticulaire.
Leur noyau basal est
allongé
et riche en chromatine.
Leur
cytoplasme renferme des mitochondries, du réticulum lisse, une sécrétion
( ?) en flaques peu denses et des microtubules. La plus interne
d’entre elles est hérissée de microvillosités
au contact de la gaine
cuticulaire ; l’étroite cavité
extracellulaire qui les
sépare renferme un matériel dense estompant la gaine et lui donnant peut être
naissance (Fig.64).
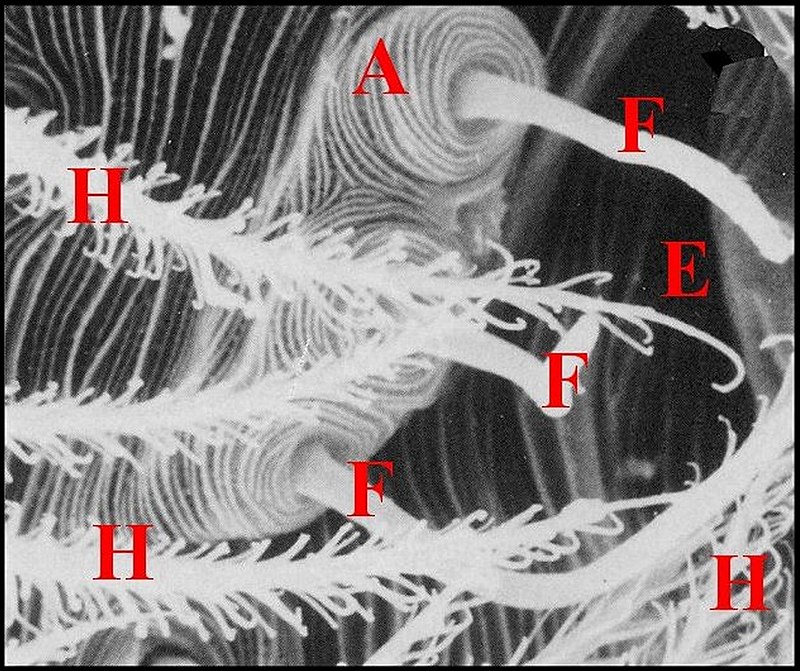
4 - Glandes exocrines tégumentaires
Un
autre type de glande exocrine, bien distinct
des organes acineux
prégonoporaux, peut être rattaché à l’ appareil épigastrique
dont il
complète la « triade » anatomique.
Il a été découvert au M.E.B. et par coupes histologiques
chez les Meta bourneti et M.menardi, chez Leucauge
argyra (Metinae) (Lopez,1986a),
et retrouvé plus tard dans deux autres
familles, les Amaurobiidae
(Amaurobius) et les Zoropsidae
(Zoropsis) (Lopez,1988).
4.a-Microscopie
électronique
Le M.E.B. montre
que les orifices excréteurs
de ces glandules sont de
simples pores siégeant
sur la lèvre antérieure
de la fente épigastrique.
Chez les Meta , ils
s’éparpillent sur sa totalité parmi les bases de fusules et
les alvéoles de poils banaux (Fig.65 à 67),
tandis que chez Leucauge argyra,
ils se limitent au seul versant postérieur du curieux «puits» en «auge»
(Fig.62). Ils
sont dispersés à la surface du tégument,
sans ordre apparent mais toujours de niveau avec elle. Solitaires ou
agminés (Fig. 66,67), ils ont une forme arrondie, un diamètre assez
variable (1
à 3 µm) et ne possèdent pas de bourrelet marginal.
 |
 |
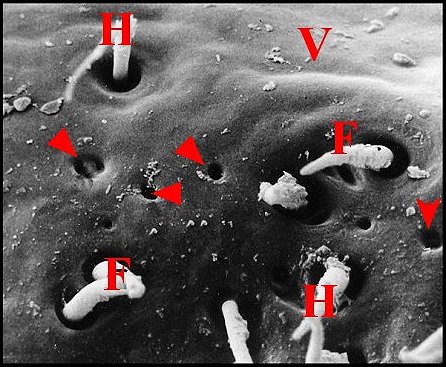 |
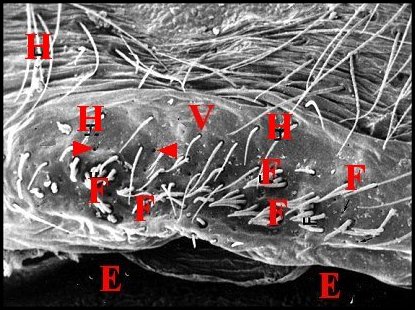
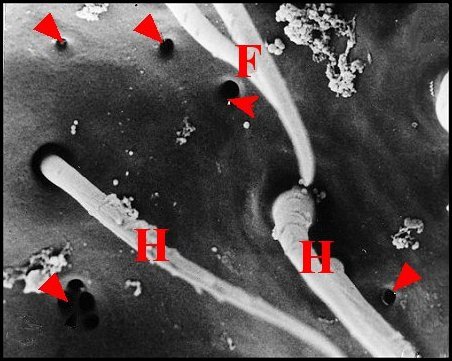
| Fig.65 - Meta menardi : région épigastrique, vue
d'ensemble |
Fig. 66 - Meta menardi : lèvre antérieure, détail |
Fig.67 - Metabourneti : lèvre antérieuree, détail |
| E, fente épigastrique - F, fusules - H, poils - V, face ventrale de l'épigastre (lèvre antérieure). Flèches : pores excréteurs (© A.Lopez M.E.B) | ||
4.2-
Structure histologique
Les coupes histologiques passant par les pores
montrent nettement qu’ils correspondent à
la terminaison de canalicules
excréteurs. Brefs et
rectilignes, ces derniers se détachent du pôle
apical de cellules
glandulaires logées dans l’épiderme sous-jacent et aboutissent aux orifices
excréteurs. Il s’agit de gros adénocytes
en cône allongé (L = 50 à 60
µm), indépendants les uns des autres et entourés par des cellules
épithéliales plus ou moins
pigmentées (Fig. 68). Leur noyau vésiculeux (D = 10 µm) montre un
gros nucléole et est surmonté par une aire acidophile
ovoïde (L = 12 µm), le «réservoir».
Ce dernier est finement strié en travers, indice de microvillosités, contient l’origine
du canalicule
excréteur et doit
correspondre sur le plan ultrastructural à un «appareil terminal» («end
apparatus»), tel que Mercer et
Brunet (1959) l’ont défini pour la première fois chez la Blatte.
Des cellules
canaliculaires satellites à noyau
ovoïde
« tigré » sont repérables sous la cuticule
(Fig.68).
 |
 |
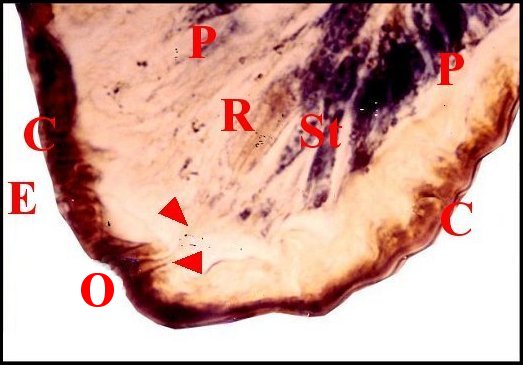 |
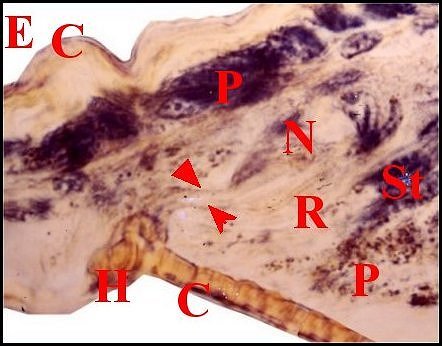
| Fig. 68 - Meta menardi, lèvre antérieure de la
fente épigastrique : coupes histologiques sagittale et parasagittales
montrant des glandules
exocrines tégumentaires. |
||
| C, cuticule ; D, canalicule excréteur de glande prégonoporale ; E, fente épigastrique ; F, fusule ; H, poil ; N, noyau d'adénocyte ; O, orifices excréteurs ; P, épiderme ; R, réservoir ; St, cellule canaliculaire satellite. Flèches : canalicules excréteurs des glandules exocrines (© A.Lopez M.E.B) | ||
5 - Commentaires
5.a. Au point de vue anatomique,
5.a.1 - les
organes prégonoporaux,
lorsqu’ils existent, sont des glandes exocrines
pluricellulaires fondamentalement semblables chez toutes les Araignées
mâles malgré
des différences de taille, de nombre et, plus accessoirement, de forme.
Leur
structure histologique diffère de celle des glandes annexes présentes dans la (les) spermathèque(s), l'atrium génital des Araignées
femelles, ainsi que
des autres organes glandulaires décrits dans ce sous-site, d'autant
plus qu'ils se composent surtout d'unités
à cellules de classes 1
et 3 selon Noirot et
Qennedey (1974, 1991).
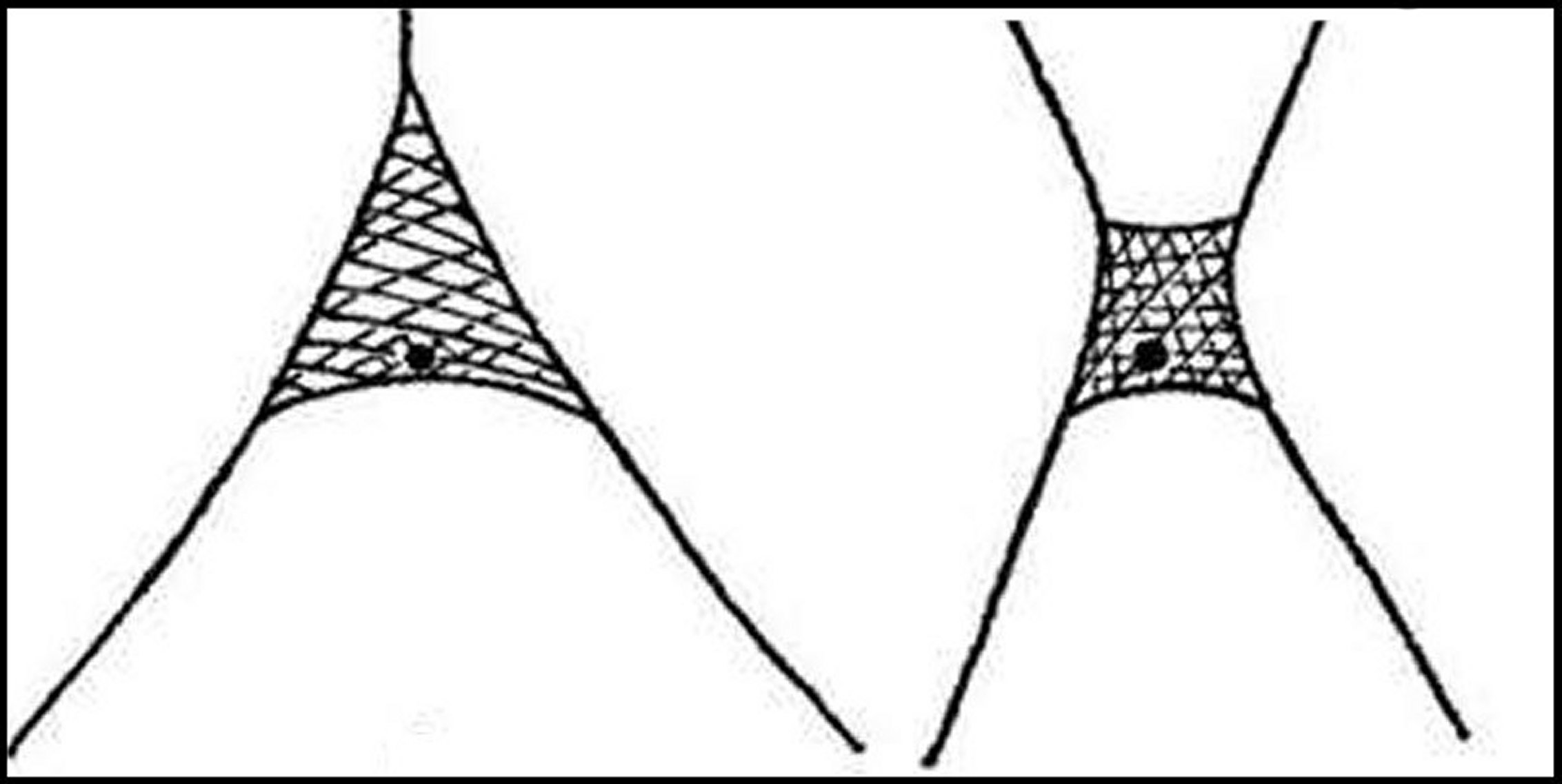
La classe 3 avec son
appareil terminal (Schéma 2) est ici absente.
Elle rappelle en
revanche étonnamment celle des glandes
séricigènes. Dans
les deux cas, la sécrétion d'un épithélium
glandulaire commun, sans revêtement de
cuticule, se concrète en
boules acidophiles qui passent dans la lumière, s’y
fusionnent et sont ensuite drainées par un canal excréteur aboutissant
à
la fusule
terminale.
D'abord notée par Melchers
(1964) puis par Marples
(1967 : «epiandrous glands»), leur ressemblance est telle que Kaestner (1968),
s’inspirant du
premier auteur, n’hésite pas à signaler des «glandes à
soie» dans l’extrémité antérieure de l’abdomen
aranéidien. Pour sa part, l'auteur a qualifié de
«glandes
E» les organes
prégonoporaux de
Pholcidae
(Lopez,1973a) afin de les
comparer aux glandes à soie
«A»
et «B» décrites par
Millot (1929,1931)
dans cette famille. La même ressemblance histologique
a été largement soulignée ensuite
pour un grand ensemble d’ Araignées
mâles (Lopez,1971
; Lopez,1977) et,
par Legendre (1972), chez
la Mygale Scodra calceata.
Au point de
vue ultrastructural, le canal
excréteur se rapproche beaucoup delui des glandes à soie,
notamment les aciniformes du type B
(Kovoor
& Zylberberg,1974). Le corps
glandulaire montre une même
organisation de base mais il existe cependant des
différences sensibles dans la qualité des organites (réticulum,
appareil de Golgi),
le mode d’extrusion de la substance élaborée et sa nature même(Lopez,1973a).
L’épiderme
modifié entourant le canal
avant qu’il ne pénètre dans sa fusule (Fig.9,29,30)
pourrait bien être une glande
à
cellules de
classe 1 (schéma1) au sens de
Noirot et Qennedey (1974, 1991).
5.a.2.- En ce
qui concerne les organes
gonoporaux, rappelons que l'auteur les avait d'abord décrits comme
également
sécréteurs (Lopez,1972) et
entrant dans le cadre de ses prétendues "glandes hypodermiques
monocellulaires et
canaliculées" (Lopez,1974b ; Lopez,1977).
Un
examen au M.E.B., non alors réalisé, aurait pu prouver l’absence
complète d’orifices excréteurs, seules
structures pouvant révéler des glandes
sous-jacentes.
Par la suite une meilleure
connaissance des structures nerveuses au M.E.T. lui a montré qu’ils
ne peuvent être des
glandes mais
plutôt des organes sensoriels et que sa première interprétation était
donc erronée.
Les
organes gonoporaux font partie
des sensilles mécanoréceptrices, structures spécialisées
dans la perception des stimuli externes qui s'exercent sur
la cuticule tégumentaire
chitineuse,
véritable «exosquelette».
Dans
le cadre général de ces sensilles
mécanoréceptrices, les organes
gonoporaux se rattachent plus spécialement aux
mécanorécepteurs cuticulaires type I de Mac Iver
(1975),
formations associant
de même un composante chitineuse
ou cuticulaire, des cellules
sensorielles ou neurones
et des cellules enveloppes. Leurs
dendrites neuronaux
renferment toujours un corps
tubulaire, structure éminemment
caractéristique des sensilles
d’Arthropodes décrite
pour la première fois par Thurm (1964)
chez l’Abeille domestique. La composante cuticulaire peut
être
un poil ou ses
dérivés (sensilles à poil des
Araignées, Crustacés et Insectes), une fente
ou lyrifissure comme pour les
organes lyriformes pédiculaires
et, dans le cas présent, une
papille
évoquant le dôme chitineux
des
Insectes. Ils semblent
ainsise
rapprocher
surtout des sensilles campaniformes qui caractérisent ces derniers et
dont
Pringle (1938) a découvert le rôle, bien que leur
neurone soit toujours unique
(MacIver,1975)
alors que l’innervation est
multiple, au moins double, chez tous les Arachnides (Araignées,
Scorpions, Acariens…).
5.b. Au point de vue fonctionnel,
et comme l’a
constaté Melchers (1964) dans
ses belles observationsur une
Mygale Pamphobeteus,
les organes prégonoporaux
sécrètent un matériel qui est déposé sur la toile spermatique
préalablement construite également observée chez d'autres espèces en
élevage (fig. ) et n’en forme donc pas le tissu même.
En effet, ce dernier est tissé avec
des fils qu’émettent par leurs
fusules les filières de
l’extrémité
abdominale.
Les nombreuses notes (par exemple Gerhardt
& Kaestner,1938 en
particulier)
où sont décrites la diversité de forme et la confection des toile spermatiques en témoignent. Dans le
cas
des Clubionidae il est même
possible que certaines
des glandes séricigènes observées
chez le mâle
(Wasowska,1969) les produisent
électivement.
 |
 |
 |
 |
|
Fig.69 - Deux aspects
schématisés de toiles spermatiques (Linyphia
et Ero
(selon Gerhardt) D'après Internet
|
Fig.70 - Mygale mâle (Acanthosurria) tissant sa vaste toile spermatique.
Elevage. D'après Internet |
Fig.71 - Linyphiide mâle et toile spermatique en triangle, vue de face. D'après Internet | Fig.72 - Linyphia
mâle remplissant un bulbe sur sa toile vue de profil (induction). D'après Internet |
|
B, bulbe - SE, sécrétion blanchâtre des
glandes prégonoporales vue par transparence - TSp, toile
spermatique, désignée par flèche in fig.72.
|
|||
De plus, les mêmes fusules de glandes à soie sont très saillantes, orientables, donc susceptibles d’une activité ordonnée dans le tissage de la toile spermatique alors que les fusules épigastriques sont immobiles, souvent enchassées dans un «puits» et ne peuvent qu’émettre un matériel amporphe.
La Mygale Pamphobeteus est certes un matériel de choix par sa taille mais ne saurait constituer un cas d’espèce, de sorte qu’il paraît fort logique d’extrapoler son acte à toutes les Araignées pourvues de glandes acinoïdes prégonoporales. La carence d’observations semblables dans la littérature arachnologique peut être liée à la taille beaucoup plus petite des autres espèces étudiées, ce qui rend l’observation malaisée, à la brièveté de l’acte qui passe ainsi inaperçu, et surtout, à la possible quasi-simultanéité de l’éjaculation primaire et du dépôt épigastrique prégonoporal.
De leur côté, les organes gonoporaux sont des structures sensorielles percevant comme tout mécanorécepteur, une déformation du corps par des stimuli externes. Dans ce cas particulier, il s’agirait des pressions exercées à leur surface lorsque le mâle d’ Araignée «frictionne» la lèvre antérieure de sa fente épigastrique sur la toile spermatique ou un autre support («masturbation»). Leur curieuse disposition linéaire chez les Pholcidae (Fig.67) tout comme d’ailleurs celle des fusules (Fig. 33,35), pourrait être en rapport avec la structure de la toile spermatique réduite à un seul fil que l’ Araignée passe transversalement au travers de son orifice génital. Si tel est le cas, une répartition analogue devrait se retrouver chez les Scytodidae et les Palpimanidae car ils tissent aussi une toile spermatique rudimentaire (Gerhardt et Kaestner,1938 ; Dabelow, 1958).
Dans
tous les
cas, la
stimulation des organes gonoporaux qui en
résulte provoquerait une dépolarisation
(signal électrique) via le corps
tubulaire et la membrane
dendritique ainsi que Thurm
(1964), Rice & al.
(1973) l'ont proposé pour d'autres organes d'
Arthropodes, puis, selon
un «arc
réflexe », le dépôt de
la sécrétion des glandes
épigastriques acinoïdes (lorsqu’elles
coexistent) ainsi que l’émission du sperme
(éjaculation primaire) sur cette même sécrétion prégonoporale.
5.c- Au point de vue ontogénique, l’appareil épigastrique pourrait dériver d’une ébauche « épiandrique » appendiculaire commune, bien qu’il soit constitué par trois formations distinctes n’ayant pas la même activité physiologique. Cette hypothèse repose essentiellement sur :
►
la ressemblance des glandes
prégonoporales et des glandes
séricigènes qui montrent
une
même organisation de base sur
les plans
histologique et ultrastructural .
►
sur la forte tendance
des fusules à la
bipartition, devenue évidente chez les Tetragnathidae
(Fig. 49).
► le caractère pair des organes gonoporaux,
► sur le fait que les glandules présumées phéromonales sont semblables à celles, dites segmentaires, qui se localisent sur la base d’appendices (chélicères, rostre, lames maxillaires, coxae, filières).
Dès lors, l’appareil épigastrique correspondrait dans son ensemble à des structures vestigiales, restes d’appendices disparus, utilisés initialement dans la vie sexuelle puis incorporés au sillon génital (lèvre antérieure) des Araignées mâles adultes. Il pourrait être ainsi homologué aux gonopodes et glandes annexes des Amblypyges mâles (Lopez,1986b).
Une telle théorie est cependant infirmée par les fusules des Mygalomorphes et Liphistiomorphes, généralement considérées comme «primitives», en tout cas plus «anciennes» que les Araignées Tetragnathidae, et qui, à priori, devraient montrer une bipartition encore plus évidente que chez ces dernières alors qu’elles sont remarquablement dispersées dans le cas des Mygales étudiées !
5.d- Au
point de vue étho-écologique
et comme le présumait déjà Marples (1967),
la présence de glandes
acinoïdes
prégonoporales
nous paraît être sans aucun rapport avec le mode de vie et
l’environnement
naturel de l’animal. Un exemple frappant est celui des Araignées
aquatiques
intertidales
et dulçaquicoles parmi lesquelles Amaurobioides
africanus en est pourvu (Fig. 12),
tandis que
Desis et Argyroneta ne
possèdent que des organes gonoporaux
(Fig.60,61).
5.e.- Au point de vue phylogénétique, il serait séduisant de pouvoir impliquer la taxonomie dans le conditionnement de l’appareil épigastrique.
Il
y a près de 40 ans, l'auteur a tenté, d’établir un rapport entre ce
dernier et
la classification des Araneides
(Lopez,1974a
; Lopez,1977). Ce rapport était essentiellement basé sur
le fait étonnant que toutes les
Araignées ne possèdent
pas de glandes acinoïdes
prégonoporales et,
qu’en en
tenant
compte, 4
groupes distincts peuvent être
individualisés
au sein de l’ordre. Le groupe I
réunit des
espèces dont
les mâles ne semblent montrer que des glandes prégonoporales (Liphistiomorphae, Theridiidae, Araneidae, Hersiliidae, Filistatidae). Les groupes
II et III
sont dépourvus
de glandes prégonoporales
mais possédent en revanche des organes
gonoporaux, soit profonds et aboutissant au canal commun terminal
(Segestriidae, Dysderidae), soit
superficiels et se terminant sur la lèvre épigastrique antérieure
(Argyronetidae, Desidae, Clubionidae, Thomisidae, Lycosidae, Zoropsidae). Le groupe
IV est «mixte» car
il
associe les deux types d’organes,
prégonoporaux et gonoporaux, ces deniers
pouvant être soit dispersés (sous-groupe
1 :
Pholcidae) (Fig.58), soit
agminés (sous-groupe
2) dans
la plupart des autres cas. En 1974, il réunissait déjà un grand nombre
de familles, notammenrt les Eresidae, les Uloboridae, les Salticidae, au moins
certains
Thomisidae, les Eusparassidae, les Agelenidae, les Oxyopidae
et les Pisauridae. Ce sous-groupe
2 est donc trés
étendu et a paru d’importance croissante au détriment du groupe I
Il paraît cependant difficile d’établir une corrélation entre la phylogénie et les glandes épigastriques (présence ou absence, aspect et disposition de leurs fusules) (Lopez,1988).
Trop de discordances peuvent en effet se manifester :
∙ au niveau familial, comme chez les Clubionidae parmi lesquels Phrurolithus flavitarsis possède des glandes prégonoporales acineuses et fusulées tandis que Chiracanthium punctorium en est dépourvu - ce qui s'explique aujourd'hui par son appartenance à une toute autre famille : les Miturgidae !) et chez les Salticidae dont l’espèce Salticus scenicus montre des fusules s’espaçant en une seule file incurvée (Fig.42) alors que celles de Saitis barbipes sont réunies en deux groupes distincts (Fig.54). Il semblerait aussi que les Lycosidae et Thomisidae mâles soient parfois dépourvus de glandes prégonoporales.
∙au niveau générique, comme chez les Argyrodes
(Theridiidae) dont
certaines
espèces n’ont qu’un nombre très réduit de
glandes épigastriques (A.elevatus :
2 en général)
et d’autres, sensiblement plus élevé (A.cognatus : 8 à 10,
avec 2
groupes de fusules).
Il s’agit donc là d’une classification isolée, trop artificielle et aussi fragile que les anciennes tentatives de taxonomie ayant pour seule base un caractère anatomique isolé (cœur, poumons, glandes à soie…). L’étude de l’appareil épigastrique ne pourra acquérir une valeur réelle en taxonomie que si elle est étayée par d' autres critères d’ anatomie interne (glandes rostrale, venimeuses, gnathocoxales, segmentaires, séricigènes...).
Bibliographie
Dabelow, S.,1958.- Zool. Jahrb (Syst.), 86, p.85-126.
Fage, L. & A.de B. Machado, 1950.- Archs. Zool. Exp. Gén. (Notes et Revues), 87, p.95 –103.
Gerhardt, U. & A. Kaestner.,1938.- Araneae in W.Kükenthal & T. Krumbach : Handb. der Zool., 3 (2), p. 394-656, Berlin und Leipzig.Kovoor,J. & L.Zylberberg., 1974.- Ann.Sci.nat.,Zool.,Paris, 16, p.5-26.
Legendre, R., 1972.- C.R.Acad.Sci.Paris,
274,
p.542-545..
Lopez,A.,1971 (avec
R.Legendre).- C.R.Acad.Sci.Paris, 273, p.1725-1728.
Lopez,A.,1972.-
Bull.Soc.Zool.France,97(2),
p.113-119.
Lopez,A.,1973a.-
C.R.Acad.Sci.Paris, 276,
p.2681-2684.
Lopez,A.,1973b.(avec
D.Llinares)- Bull.Soc.Zool.France,98
(2), p.307-312.
Lopez,A.,1973c
(avec R.Legendre)- Bull.Soc.Zool.France,98 (4), p.487-494.
Lopez,A.,1974a.-
Bull.Assoc.Anat.,
58,n°163,Dec.1974, p.899-904.
Lopez,A.,1974b.-
Forma et Functio,7, p.317-326.
Lopez,A.,1976.-
Zool.Jb.Anat.Bd.96,S.p. 173-182.
Lopez,A.,1977.- Contribution à l‘étude des caractères sexuels somatiques chez les mâles des Aranéides. Thèse Doct.Etat es.sciences, Avril 1977, Univ.Montpellier II, 150pp.
Lopez,A.,1980. (avec C.Ribera)- Proth. 8 th. Intern.Arachnol. Congr.,Wien, July
7-12 1980, p. 303-307.
Lopez,A.,1985
(avec M.Emerit).- Rev.Arachnol., 6, 2, p.81-89.
Lopez,A.,1986a. (avec M.Emerit).-
Bull.Soc.Et.Sci.nat.Béziers,
N.S.,XI (52), 1986, p.56-60.
Lopez,A.,1986b.
(avec M.Emerit).- – Acta X
Congr.Int.Aracnol. Jaca/España, 1986. II : 25-40.
Lopez,A.,1988 (avec
M.Emerit).- Bull.Br.arachnol.Soc.(1988),7 (7), p.220-224.
Lopez,A.,1997
(avec B.Lopez).-
Mém. Biospéol., XXIV, 1997, p. 33-42.
Lopez, A.,1994.- Bull.Soc.Sciences nat., 81, p. 7-15.
Machado,
A.de B., 1951.-
Publçoes
cult.Co.Diam.Angola, 8, p.9-87.
Mac Iver,
S.B.,1975.-Ann.Rev.Ent.,20,
p.381-397.
Marples, B.J.,1967.- J.Linn.Soc.(Zool.),
46,
p.209-223.
Melchers,
M.,1964.- Zeits.Morph.Ökol.
Tiere, 53, p.517-536.
Mercer.,E.H.
& P.C.J. Brunet., 1959.- J.
biochem. biophys. Cytol., 5, p.257-262.
Millot,J.,1929.-
Bull.Soc.Zool.France,54, p.194-206.
Millot,J.,1931.-
Bull.Soc.Zool.France,56, p.75-83.
Noirot,C.
& A. Quennedey.,1974.-
Ann.Rev.Ent., 169, p.61-80.
Noirot,C. & A.
Quennedey.,
1991.- Annls
Soc.ent.Fr. (N.S.), 1991, 27 (2), p.123-128.
Pringle,J.W.,1938-J.exp.Biol.,15,
p.101-131.
Rice, M.J., Galun,R.
& L.H.Finlayson,
1973.- Nat.New
Biol., 241,
p.286-288.
Thurm,U.,1964.-
Science, 145,
p.1063-1065.
Wasowska,
S.,1969.- Zool. Pol.,
19 (4), p.506-515.