glandes segmentaires
|
L'organe rétrognathocoxal et autres glandes segmentaires des Araignées ANATOMIE ET COMPORTEMENT DES ARANEIDES : VINGT-CINQ ANS DE RECHERCHES (version
2023)
Par
André LOPEZ, auteur
|
|
Un
ensemble de glandules inédites en rapport avec la métamérisation
originelle des Araignées
|
|
Couleurs
conventionnelles :
En noir et italiques, termes anatomiques ; en violet,,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
orange,, parties
les plus importantes
et résumés
; en bleu, liens divers.
|
|
Abréviations
conventionnelles :
M.E.B.
:
(photographie en) microscopie électronique à
balayage
M.E.T. :
(photographie en) microscopie électronique à
transmission
C.H. :
coupe histologique
(microscopie photonique)
|
Préambule
1 - Introduction
2 - Description
2-1 - Localisation et rapports
2-2 - Structure générale
2-3 - Histologie
2-4 - Ultrastructure
2-4-1 - Adénocyte
2-4 -2 - Appareil cuticulaire
2-4-2.a - Canalicule récepteur
2-4-2.b - Canalicule conducteur
2-4-2.c - Cellules canaliculaires ou cellules enveloppes
2-5 - Variations
3 - Commentaires
3-1- Anatomie
3-2 - Chimie
3-3 - Fonction
3-4 - Ontogénie
Il y a plus de 40 ans, A.Lopez
(1978) découvrit tout un
ensemble de petits organes
glandulaires exocrines apparemment
métamérisés dans les
coupes histologiques du
prosoma
(céphalothorax) de Metepeira
incrassata (Araneidae
: Mexique : araignée coloniale) et de Leptoneta
microphtalma (Leptonetidae :
grottes pyrénéennes, Ariège).
Il les a retrouvées ultérieurement chez de
nombreuses autres
Araneomorphae : Araneidae, Linyphiidae,
Theridiidae, Oecobiidae
(Lopez,1983;
Lopez,1984).
Ces
organes sécréteurs tégumentaires, sont
pairs, symétriques, se situant à
la base de divers appendices,
avérés ou présumés (chélicères,
rostre, gnathocoxae), ainsi qu’au
niveau des hanches de la
première paire de pattes
ou P I (Metepeira).
Cette dernière localisation, où
elles s’associent étroitement avec les glandes coxales proprement
dites, et leur emplacements baso-métamériques,
plaidaient initialement en faveur de “ glandes coxales sensu
lato ” ou « modifiées » (Lopez,1978 ;
Lopez,1983)
(Fig.1). La conception de l'auteur était d’autant plus
justifiée qu’à première vue et au faible grossissement,
elles se présentaient comme des groupes de
« vésicules », régulières ou sinueuses, baignant dans un espace
hémolymphatique sous le
tégument ventral et donc
très évocatrices de « saccules »
coxaux.
Un peu plus tard ,
et faute de termes pouvant traduire leur(s) fonction(s), encore
inconnue(s),il les a désignées sous le nom de « glandes
épidermiques pluricellulaires segmentaires » qui paraît plus
approprié (Lopez,1984). L’ultrastructure
de leur forme
rétro-gnathocoxale (Lopez,1988)
permet
de
rapprocher la plupart d’entre elles des glandes épidermiques à
adénocytes de classe 3 (voir le schéma 2).
Ces organes, en particulier le dernier, semblent bien exister chez la plupart des Araignées étudiées et y présenter un développement d’une extrême variabilité, selon les familles et même les genres.
2.1.- Localisation et rapports
Elles
sont établies par les coupes histologiques en série qui montrent leurs
cellules constitutives
et canaux conducteurs
traversant la cuticule,
et
confirmées par la présence d’orifices
excréteurs visibles dans les
membranes d’insertion
appendiculaire au M.E.B.
Le genre américain Metepeira
(Araneidae : Araneinae), avec surtout son espèce coloniale mexicaine M. incrassata
(état de Vera-Cruz : Lopez,col.)
et, à un degré moindre, le
taxon antillais Metepeira présumée vaurieorum
(Lopez,1993,col.) représente un
matériel de choix pour leur étude. Elles y sont en effet
particulièrement
bien développées (Lopez,1978 ; Lopez,1983)
et surtout apparentes dans
les coupes histologiques horizontales
(Fig.,1
à 3, 7 à 9 ;
Schéma 1).
L’Araignée
souterraine Leptoneta
microphtalma
(Leptonetidae)(grottes
ariègeoises, Pyrénées :
Lopez,col.), en possède
également de fort bien visibles (Lopez, 1978).
Fondamentalement,
elles sont au nombre de 5 paires,
réparties dans les zones pré et post-orales du prosoma (Schéma 1).
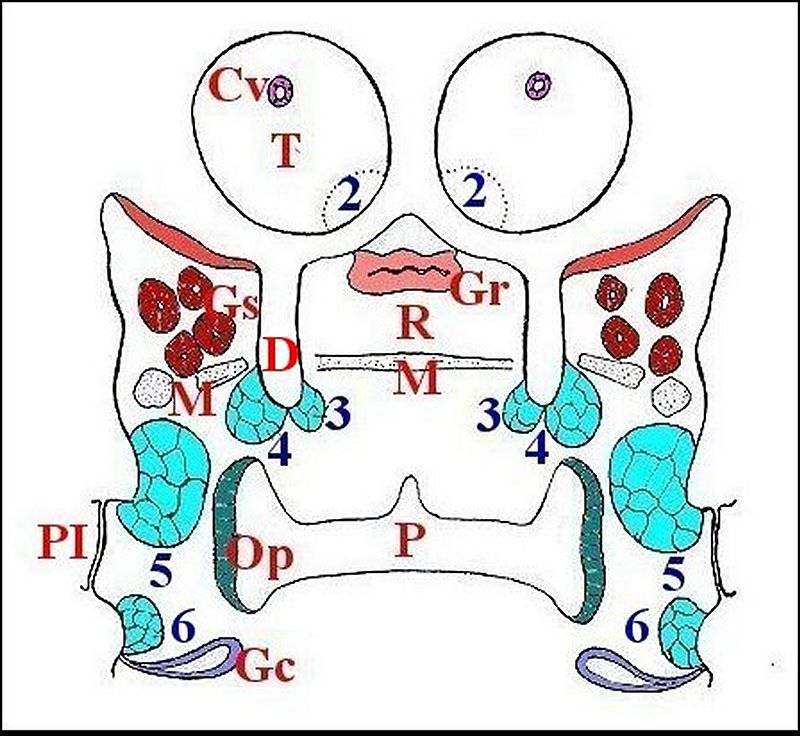 |
|
La première n'est pas visible ;
les différentes autres paires sont
ainsi numérotées de 2 ,3, à 6.
2 est figurée par projection dans la tige chélicérienne. 5 est la glande rétrognathocoxale |
| Cv, canal venimeux - D, dépression rostro-gnathocoxale - Gc, première glande coxale - Gr, glande rostrale - Gs, glandes "salivaires" - M, muscles - Op , "organe pharyngien" - P, pharynx - P I, première patte ambulatoire - R, rostre - T, tige chélicérienne (paturon). D'après Lopez, 1978, Cptes rendus Acad.Sci.Paris. |
La
première paire (1)
n’a été observée
jusqu’ici que chez la seule Metepeira incrassata. La
plus antérieure et la
plus discrète, elle est placée devant les glandes venimeuses
et siège au fond de la
dépression séparant les paturons (tiges
chélicériennes) du
surplomb
oculaire (Fig.1).
La deuxième (2),
bien visible aussi chez Leptoneta
microphtalma, se loge sous
le sillon
rostro-chélicérien, au niveau de la base du paturon
(Schéma 1, Fig.2).
 |
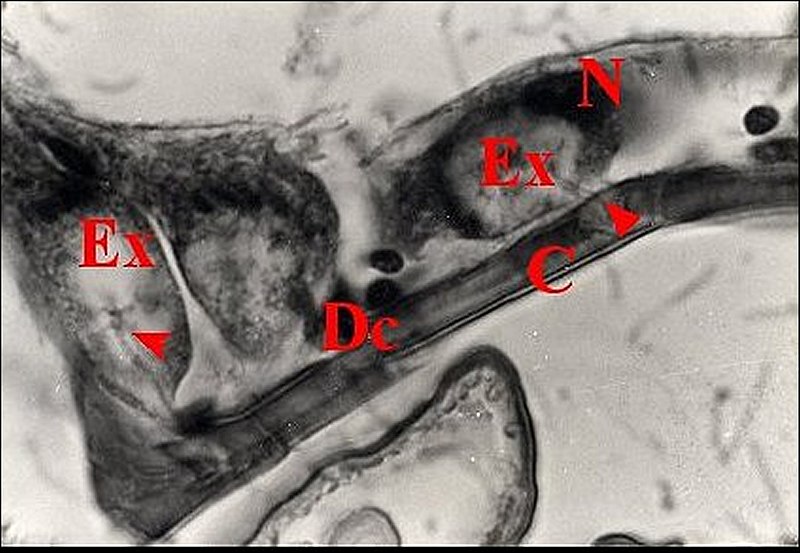 |
| Fig.1 - Metepeira
incrassata : première paire (1),
au-dessous des yeux. |
|
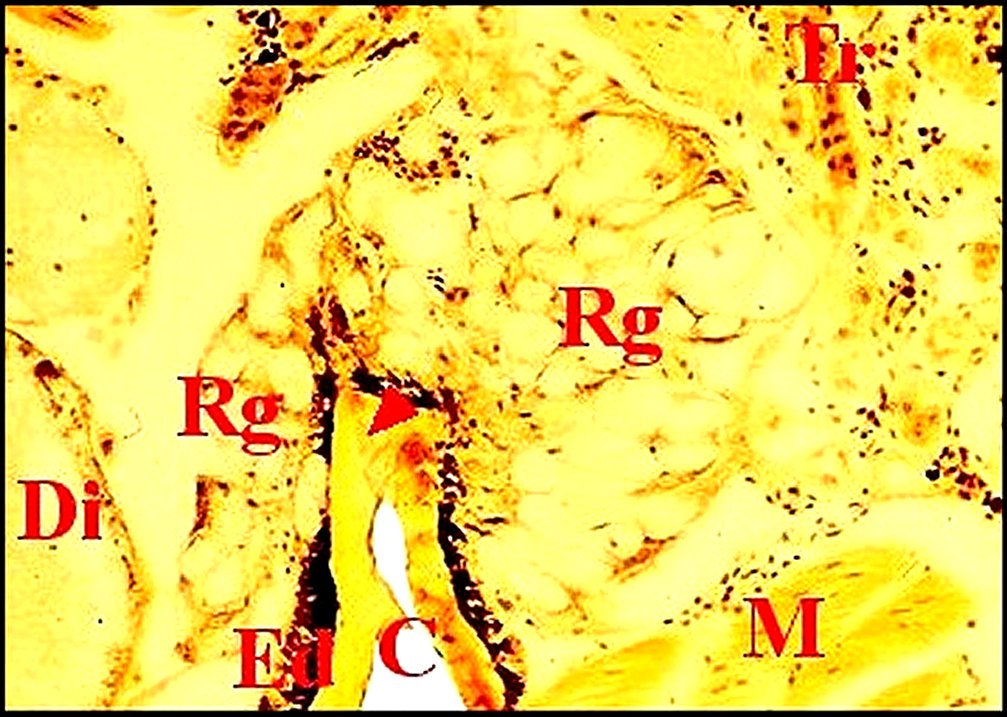
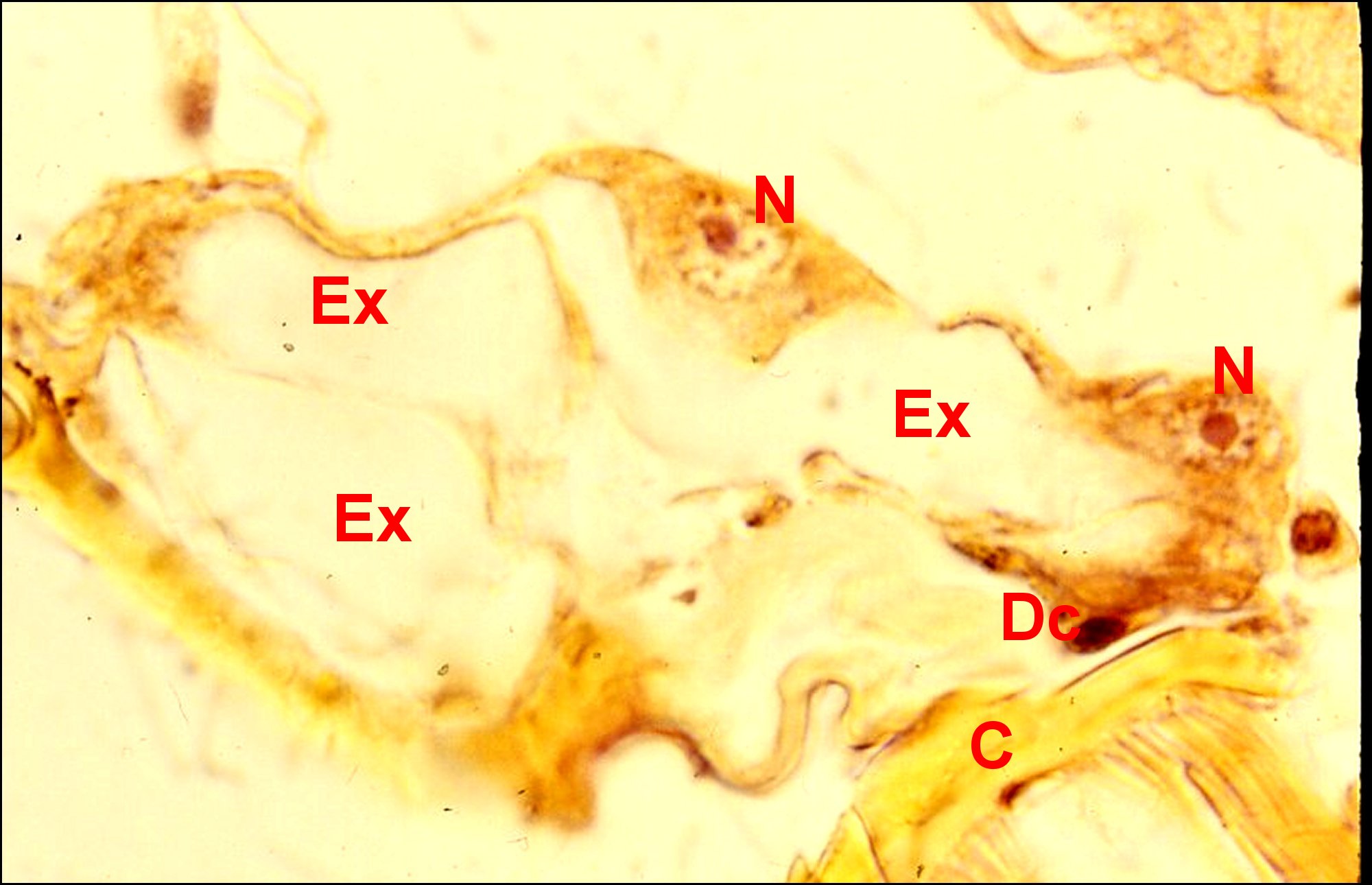
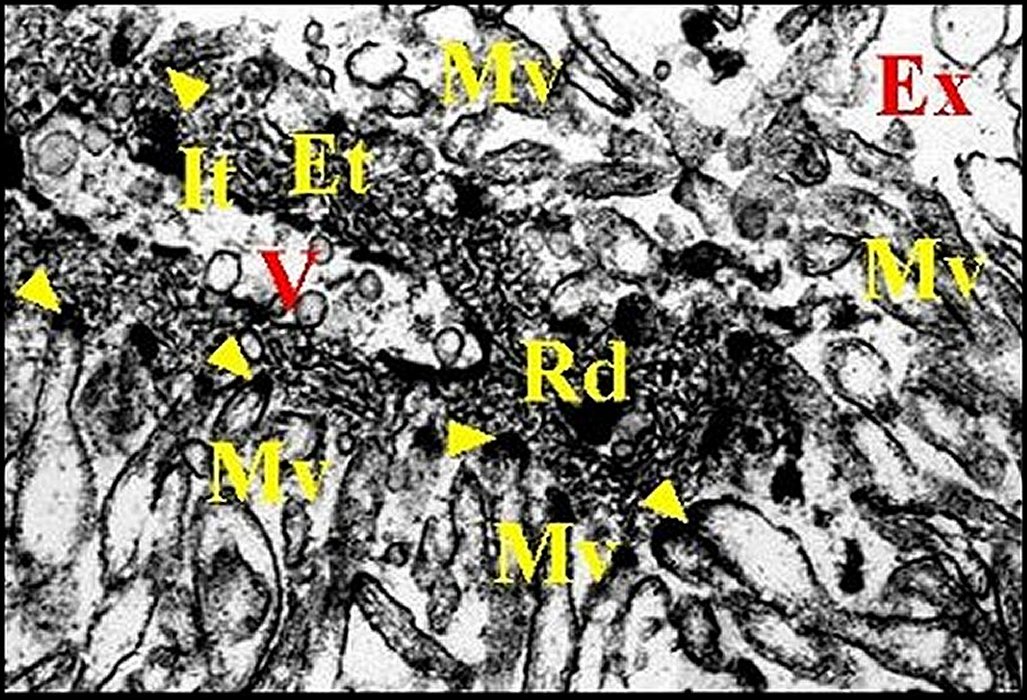
| C, cuticule - Ed, épiderme pigmenté - Dc, cellule canaliculaire - Ex, cavité extracellulaire ("réservoir") contenant le canalicule récepteur (flèches rouges ) - N, noyau d'adénocyte. Flèche jaune : canalicule excréteur (© A.Lopez C.H.). | |
 |
| c, cellule canaliculaire - Ex, cavité
extracellulaire ("réservoir") contenant le canalicule récepteur
(flèches rouges) et bordée de microvilli (Mv) - N, noyau d' adénocyte (©
A.Lopez C.H.). |
La troisième (3)(Schéma 1) est
située dans la partie
postéro-supérieure et latérale du rostre, près de
son muscle transversal et
s’ouvre
sur le versant
interne de la dépression
rostro-gnathocoxale. Son bord
postérieur (Fig. 25) entre
en rapport avec le bord antérieur de l’ «organe pharyngien» auquel
Millot (1936)
attribuait un rôle sensoriel gustatif.
La quatrième paire (4)(Schéma 1) ,
contiguë à la
précédente, siège dans la partie postéro-interne de la lame
maxillaire (gnathocoxa) et
s’ouvre sur le versant
externe de la dépression
rostro-gnathocoxale.
Toutes deux
peuvent
contracter des rapports de voisinage étroit avec le pharynx, les
glandes
"salivaires" ou "gnathocoxales", des nerfs et
des fibres musculaires
striées
(Fig.3).
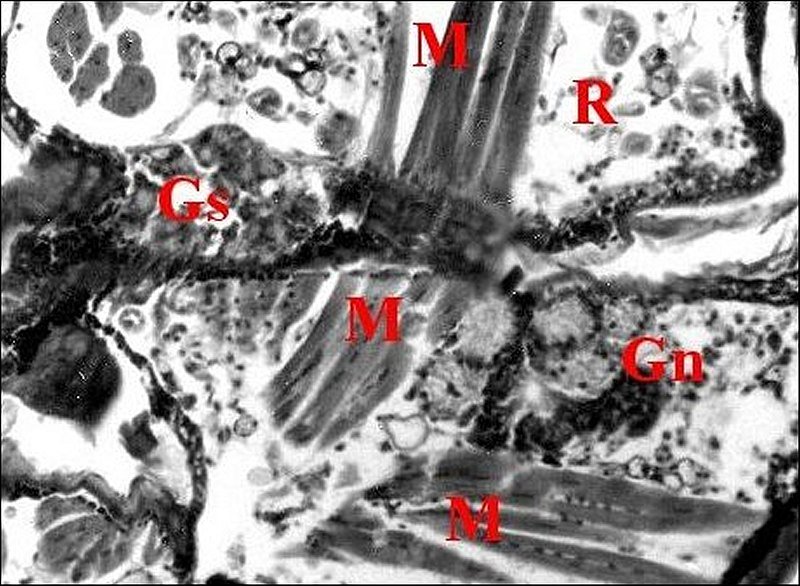 |
| Fig.4
- Metepeira
incrassata : deuxième (2)
et troisième (3)
paires, à la base du rostre |
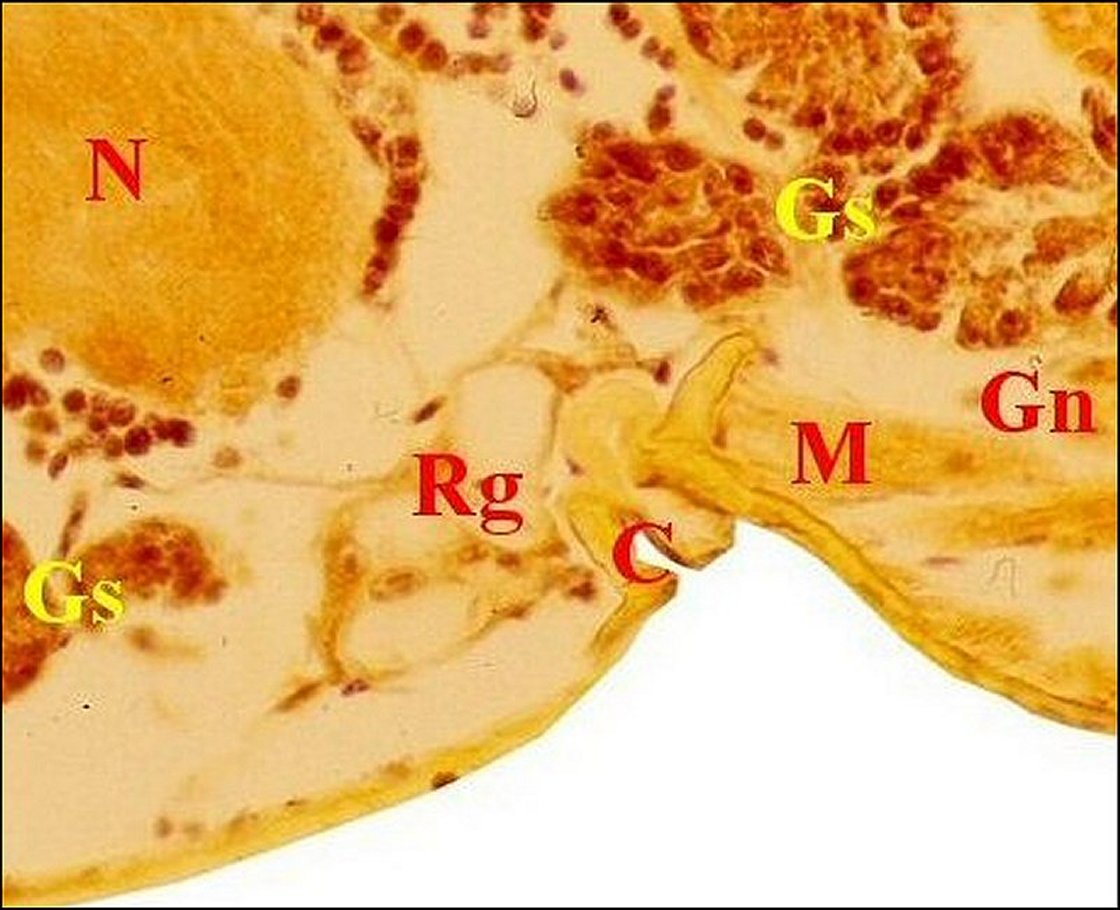
| Gn,
gnathocoxe, glandes
"salivaires" - Gs, glandes segmentaires - M, muscle - R, rostre (© A.Lopez C.H.) |
La cinquième
paire (5)(Schéma 1)
est la plus postérieure, celle qui
atteint le plus grand volume et est
presque toujours mieux visible que les autres chez la
plupart des Araignées. Elle
s’ouvre dans ou contre la membrane souple unissant la gnathocoxa au
bord antérieur du sternum
et à la hanche (coxa) de P I.
Ce débouché n’a été
observé en M.E.B. que chez Leptoneta. (Fig.5).
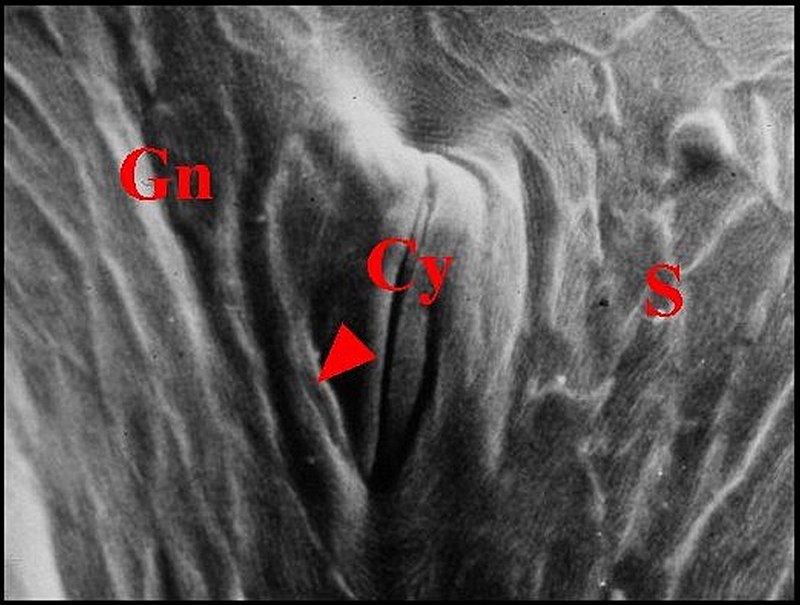 |
| Fig. 5 -Leptoneta microphtalma : localisation de la crypte rétrognathocoxale. |
| Cy,
orifice en fente de la crypte -
Gn, gnathocoxe - S, sternum. Flèche : languette (© A.Lopez M.E.B.) |
Il
s’agit d’une
formation anatomique paire, symétrique, logée dans la partie
ventro-latérale du prosoma (Fig.4)
immédiatement derrière la gnathocoxa,
d'où son
qualificatif
de rétrognathocoxale. Baignant
dans un sinus
hémolymphatique elle entre en
rapport
avec la masse nerveuse
sous-oesophagienne (ganglions), des diverticules
intestinaux, des
muscles,
du tissu
réticulé (Fig. 4, 6 à 11) et les glandes "salivaires" "sexuelles"
chez certains mâles de Linyphiidae
(Fig.11).
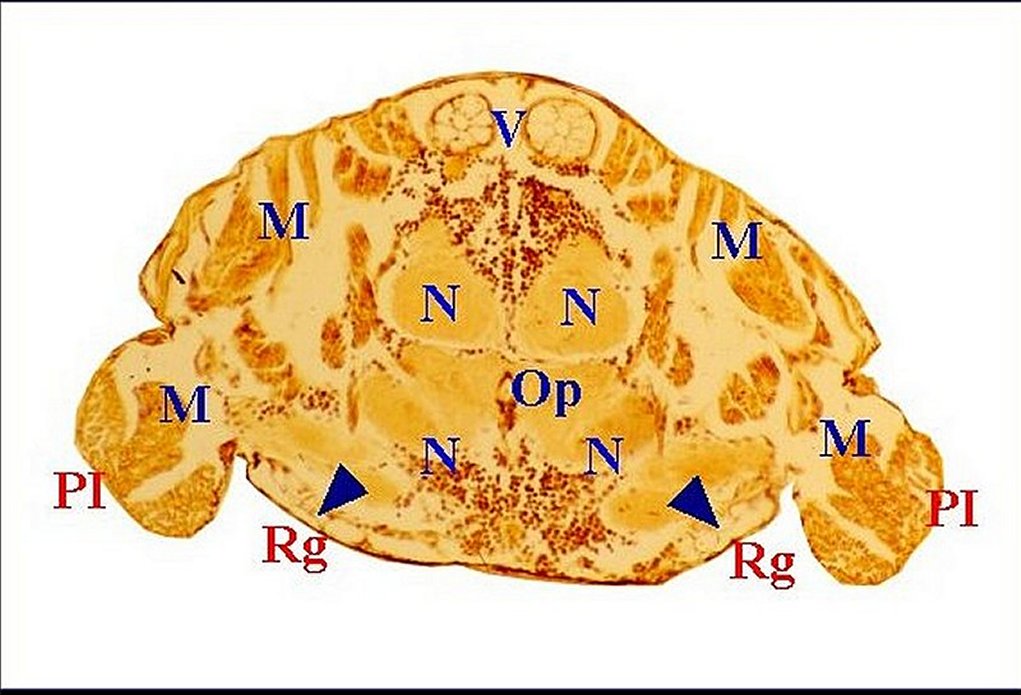 |
| Fig. 6 - Leptyphantes sanctivincentii,
femelle : coupe transversale du prosoma.
Localisation de
la 5 eme paire. |
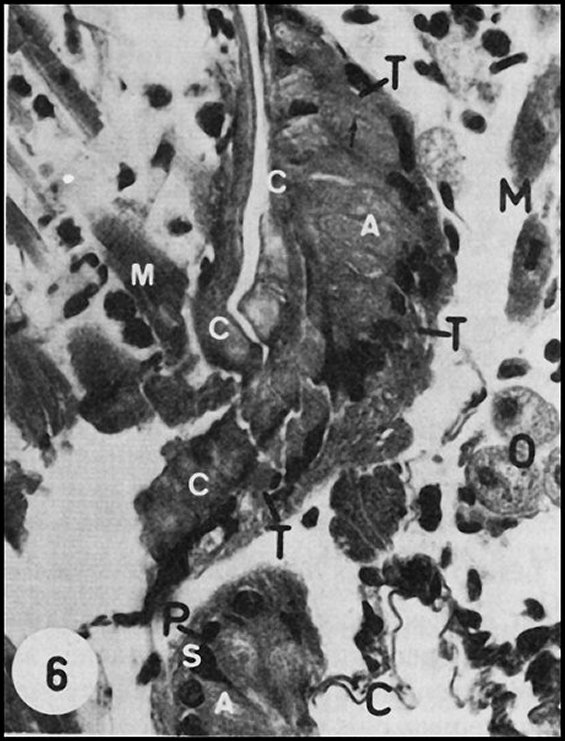
| M, muscles - N, masse nerveuse - Op, oesophage - PI, coxae premières pattes - Rg et flèches, glandes rétrognathocoxales (5) - V, glandes à venin (© A.Lopez C.H.) |
Une
6eme
paire (6) est présente
chez
Metepeira incrassata
à la base de
P I et s'y
associe au canal et à l'ouverture
de la glande coxale
proprement dite
(Schéma 1, Fig. 7).
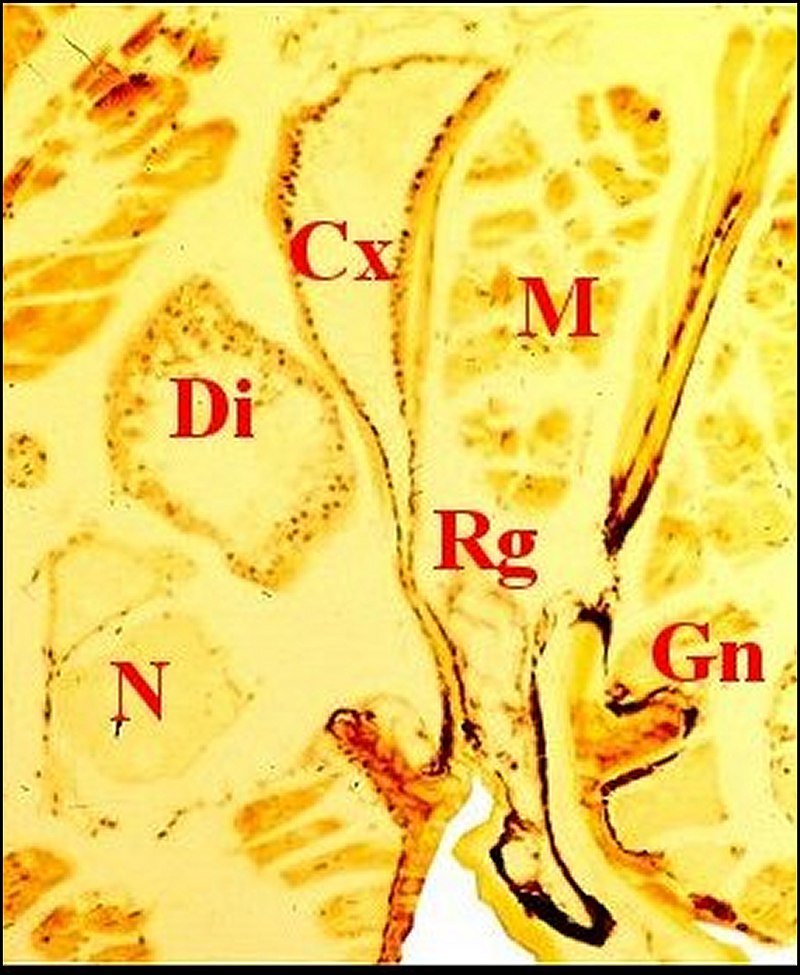 |
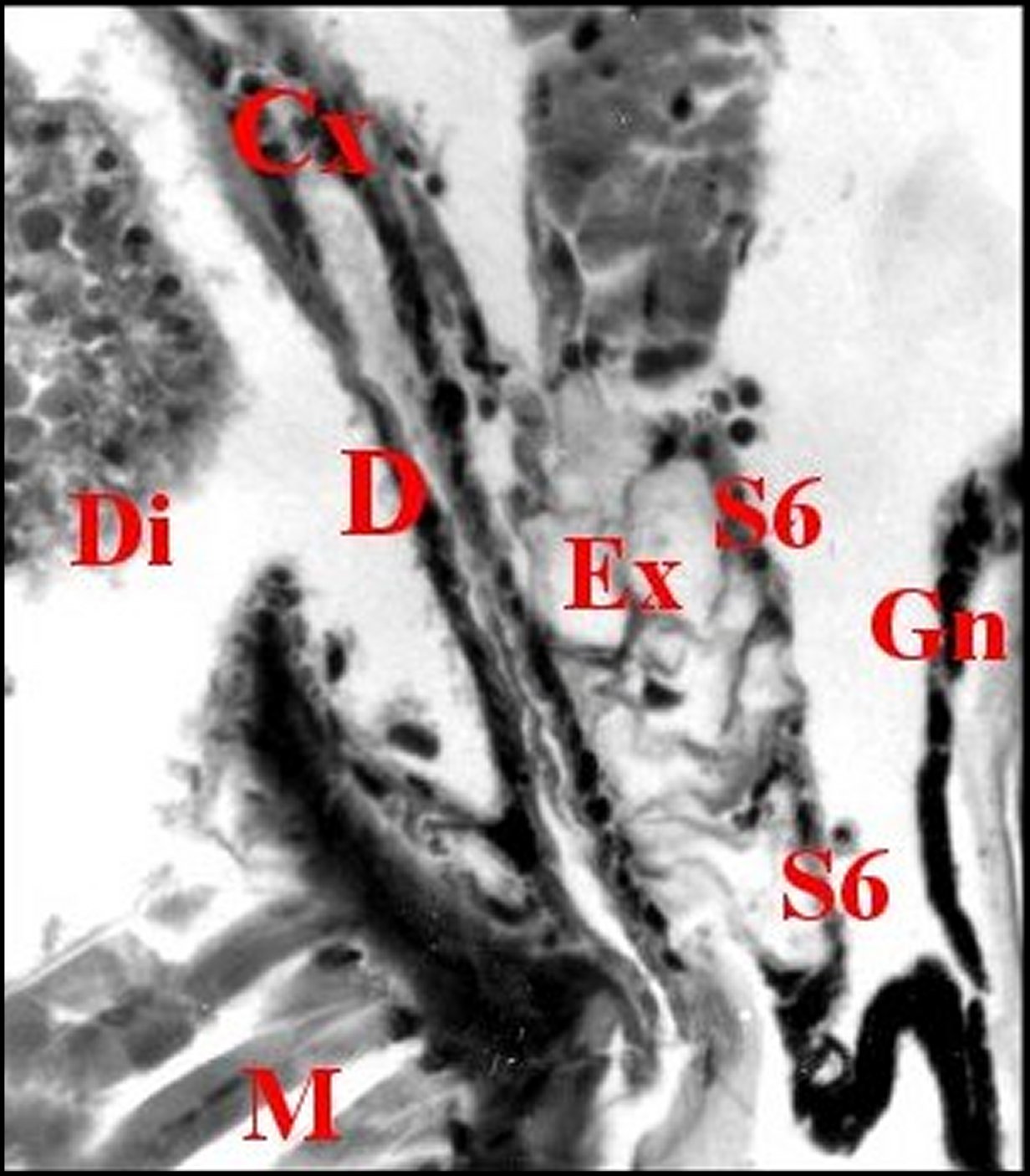 |
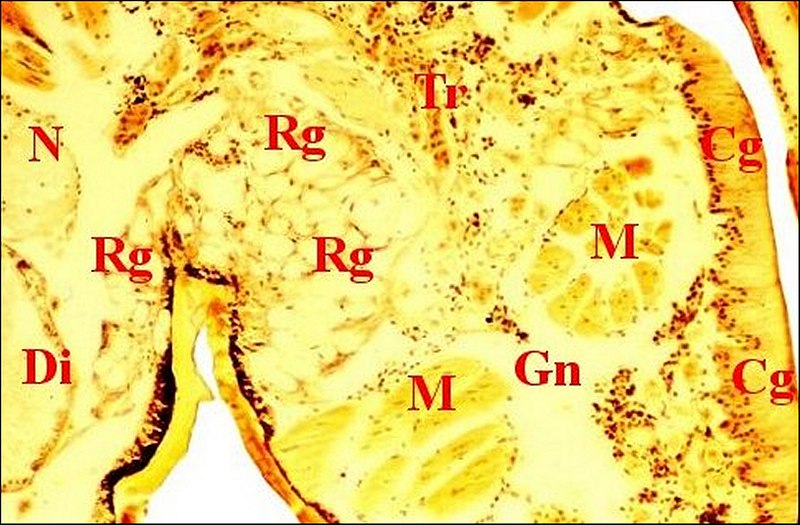 |
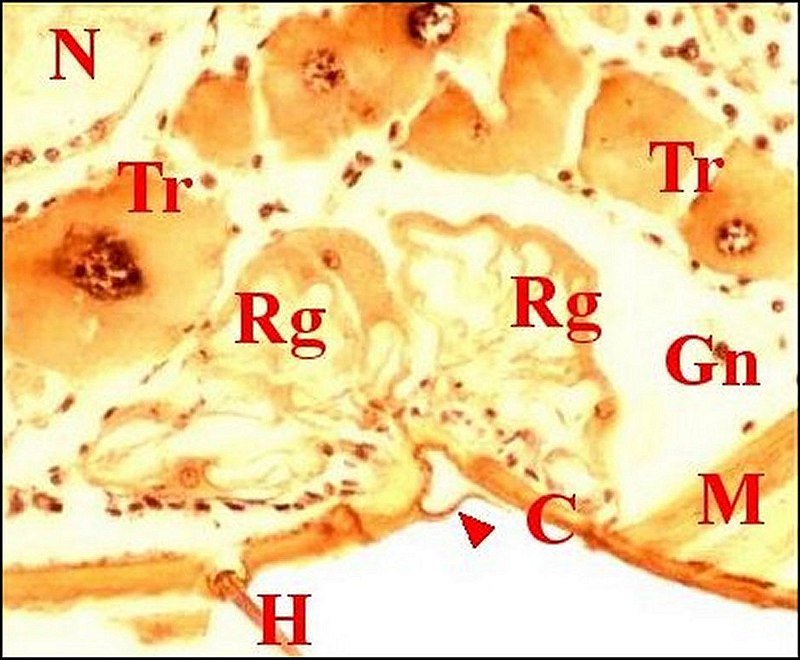
| Fig. 7- Metepeira incrassata : 6eme paire. | Fig.8 - Coupe
voisine, 6eme paire,
détail |
Fig.9 - Apparition de la rétrognathocoxale
en totalité. Plus de coxale. |
|
Cg,
glande péribuccale gnathocoxa - Cx,
glande coxale proprement dite et son canal - D, canal coxal - Di,
diverticule
intestinal - Ex.... - Gn, gnathocoxa - M, muscles - N, tissu nerveux -
Rg, glande rétrognathocoxale
- S6, 6eme paire -Tr, tissu réticulé (©
A.Lopez C.H.)
|
||
Leur
structure d’ensemble paraît assez homogène
en microscopie photonique, quelle que soit la localisation.
Les
glandes
segmentaires, du moins 3,
4 et 5
se présentent comme de petits organes
faisant partie de l’épiderme
ventral qu’ils exhaussent en «grappe» ou «coussinet » plus
ou
moins saillant. D’aspect compact ou alvéolaire, en « nid
d’abeille », ils mesurent jusqu’à 130 µm de diamètre et 80 µm
d’épaisseur, surtout dans le cas de la
paire rétrognathocoxale (5),
et baignent
dans un
espace hémolymphatique
(Fig.7 à 13).
La
structure histologique
de ces
organes exocrines paraît assez uniforme. En effet , chacun d’eux est
constitué
par un ensemble de gros adénocytes,
de cellules
« satellites » et de canalicules
excréteurs ayant
toujours le même
aspect, quelle que soit la loclisation considérée.
Les adénocytes sont des éléments réguliers, très allongés (jusqu’à 80 µm chez Uroctea durandi) plus ou moins prismatiques, en «palissade», ou ayant l’aspect de «vésicules» piriformes, ovoïdes, parfois sinueuses, dont les extrémité apicales s’effilent en convergeant vers la cuticule sus-jacente. Le quart basal renferme un gros noyau vésiculeux, à nucléole très apparent (Fig.14) et à chromatine marginale. Le cytoplasme est acidophile, vacuolisé et semble contenir, dans ses ¾ supérieurs, une cavité en «réservoir» oblong avec de vagues stries marginales ou dilaté, alors responsable de l’aspect «vésiculaire». Dans cette cavité, qui est en fait extracellulaire et parfois trés dilatée (Fig.11 à 14), se loge un grêle canalicule oxyphile, plus ou moins pelotonné sur lui-même et se dirigeant vers la cuticule au-dessus de l'apex adénocytaire (Fig. 2,3,15).
Les
cellules « satellites » sont
logées entre les adénocytes
qu’elles paraissent
soutenir. Elles sont individualisées par un petit noyau oblong, à
chromatine dense (Fig.13 à
15).
Leur cytoplasme est
très aplati et peu
visible.
Les canalicules
excréteurs sont
seulement perceptibles sous la cuticule,
au point de convergence
des apex
adénocytaires
dont ils se sont dégagés, et en
groupe
plus ou moins serré (Fig.10,12,13).
Ces
conduits traversent ensuite la
cuticule
. Elle s’invagine à leur
niveau pour former une crypte
au fond de laquelle
s’ouvrent les pores excréteurs
et que surplombe une languette en
auvent masquant ces
orifices (Fig.12,13).
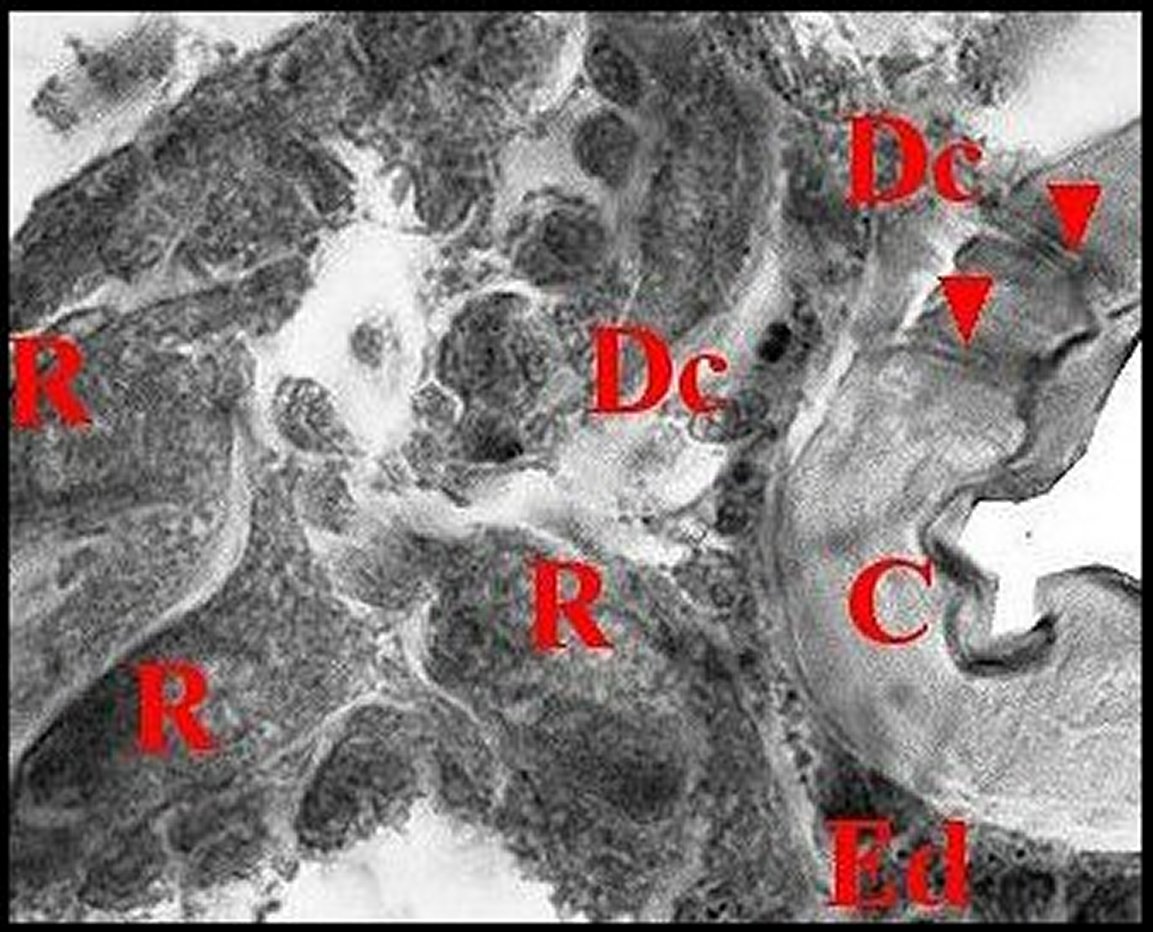 |
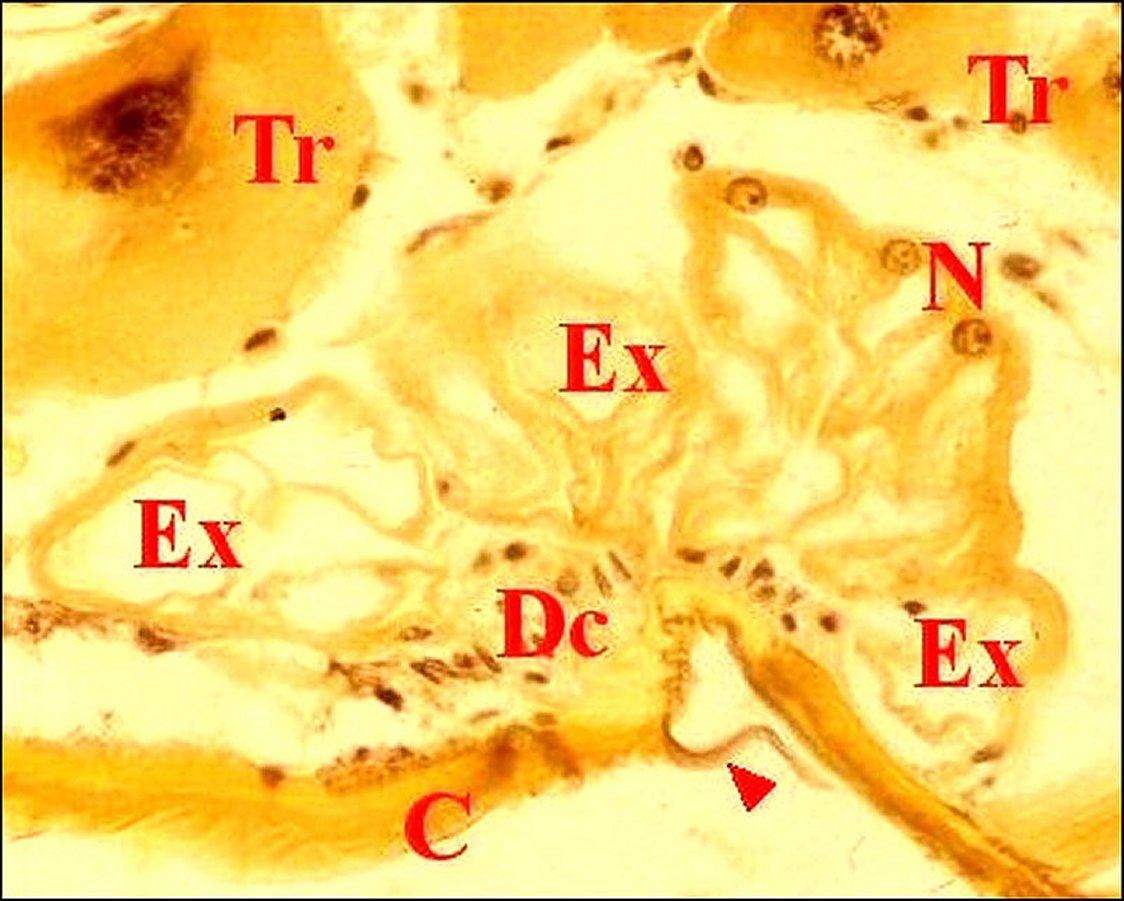
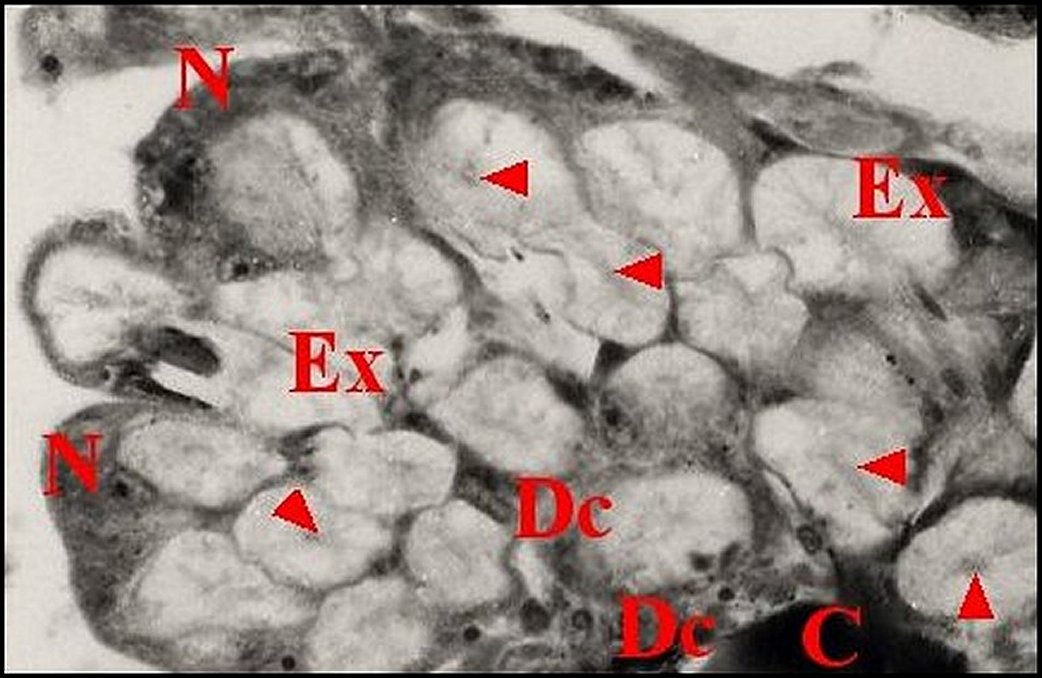
| Fig.16 - Poecilopachys australasia : détail de la rétrognathocoxale |
| C,
cuticule -
Dc, cellules satellites - Ed, épiderme - R, "réservoirs"
(cavités extracellulaires).
Flèches : canalicules traversant la cuticule (© A.Lopez C.H.) |
La structure fine n’a pu
être explorée que dans le seul cas de la paire rétrognathocoxale (5) car
elle est la plus
volumineuse, la plus accessible et, semble-t-il, la plus constante.
Nous
avons utilisé comme matériel d'étude Leptyphantes
sanctivincentii (Simon) rebaptisée par certains, sans raison
évidente, "Pseudomaro
aenigmaticus"(Linyphiidae)
(grotte de Cailhol,
Minervois : Ouest de l’ Hérault, France) et l’avons examiné en
M.E.T. au
Laboratoire souterrain de Moulis (Note 1).
Nos
recherches
montrent que cellules et
canaux
sont réunis en unités anatomo-
fonctionnelles toutes semblables. Chacune de ces unités se
compose
d’une cellule sécrétrice
ou adénocyte et d’un
appareil cuticulaire avec
deux cellules satellites
(canaliculaires) non
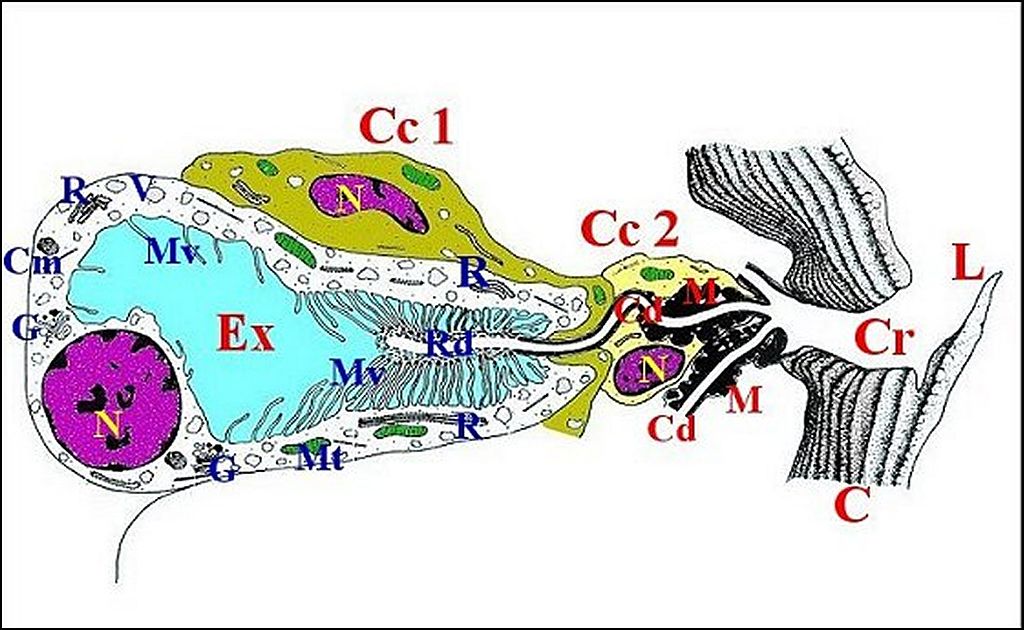
sécrétrices (Lopez, 1988) (Schéma
2).
Il s’agit d’une
grosse cellule
allongée, rétrécie
dans sa partie apicale, nettement plus large dans la basale
et longue
d’environ 40 µm. Ses contours sont réguliers car elle ne
s’engrène pas
sur les autres adénocytes
et les cellules satellites
(Schéma 2).
Son pôle
basal
est convexe, non indenté par des replis du plasmalemme
et repose sur une lame
fibrillaire
très mince l’isolant du sinus
hémolymphatique.
En revanche, son pôle
apical présente une grande
invagination de l' espace
extracellulaire en
«cul de sac» occupant le grand axe de l'adénocyte
(Schéma 2, Fig.15),
et renferme un canalicule récepteur en
position centrale (Schéma 2 ;
Fig.17,18).
Cette cavité correspond
bien
à celle des coupes histologiques (Fig.11,12,13), est exiguë dans la
partie
rétrécie («réservoir»)
où se loge le canalicule (Fig.18,
Schéma
2,) mais
s’élargit beaucoup dans la partie basale évasée («vésicule»)
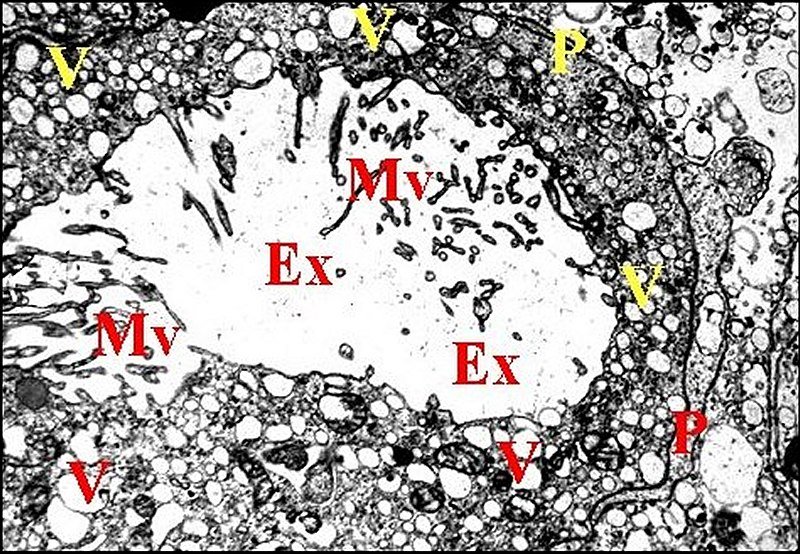
(Fig.17). Elle est bordée par des microvillosités
ou microvilli responsables de
la "striation" vue
en microscopie photonique, longues,
grêles,
flexueuses et contenant des microfilaments longitudinaux disposés en
couronne périphérique. Les microvilli de
la partie basale sont assez
peu nombreuses, irrégulières, dispersées, inégalement espacées et
semblent “ flotter ” dans la cavité extracellulaire
(Fig.17). En
revanche, les microvilli
apicales sont beaucoup plus
nombreuses, régulières, très serrées, souvent incurvées et
adoptent
alors une disposition «tourbillonnante» autour du
canalicule. Elles
prennent contact avec
ce dernier
par leur extrémité libre qu’occupe une densification
osmiophile (hémidesmosome)
due à la convergence des
microfilaments
qui s’y reploient et semblent
en quelque sorte l’ «amarrer» au cytoplasme pour le maintenir
en place (Schéma 2, Fig.18).
Le
noyau siège dans
le pôle basal, est
sphérique et d'assez grande taille (8 µm). Il renferme un
nucléole d’aspect
réticulé et une chromatine finement
granuleuse, condensée
en rares blocs périphériques, tendant surtout à se disperser dans le
nucléoplasme. Dans
les coupes
tangentielles
à son enveloppe, il
montre aussi des pores
nucléaires de fréquence moyenne, avec un
canal central parfois discernable (Fig.19,20).
Le
réticulum
endoplasmique est abondant
et granuleux. Il se compose
de
quelques groupes de cisternae
aplaties, plus ou moins sinueuses et surtout,
de vésicules de taille très
variable (Fig.20), portant
quelques ribosomes à
leur surface et
renfermant
un matériel granuleux peu dense aux électrons qu’elles vont déverser
par exocytose dans la cavité extracellulaire
(Fig.18)
entre les pieds des microvilli.
| |
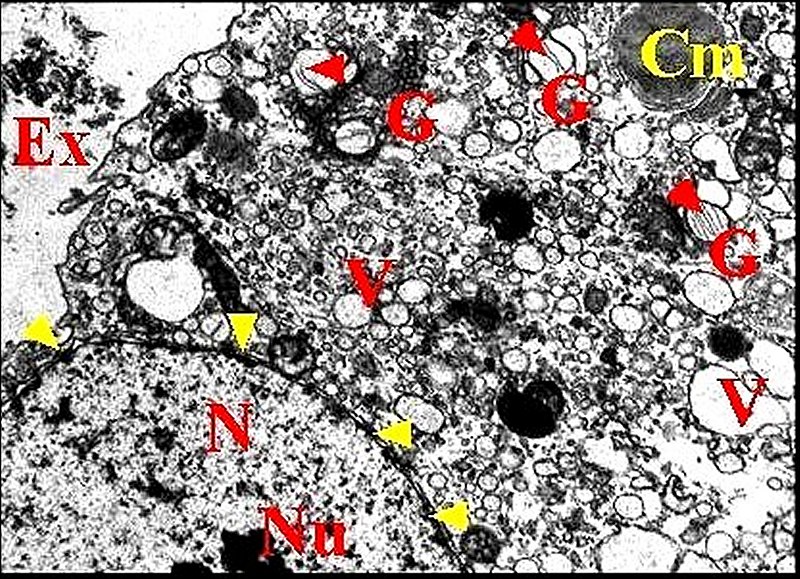 |
| Fig. 19 - Glande
rétrognathocoxale : noyau et
autres organites. |
Fig. 20 - Glande
rétrognathocoxale : noyau et
autres organites. |
| Cm, corps myéloïde - En, enveloppe nucléaire - G, appareil de Golgi (dictyosome) - L, lysosome - Mv, microvilli dans cavité extracellulaire - N, noyau -Nu, nucléole - P, plasmalemmes accolés - V, vésicules . Flèches jaunes : pores nucléaires. Flèches rouges : matériel lamellaire dans le Golgi (© A.Lopez M.E.T.) | |
L’ appareil de Golgi se
compose d’un grand nombre de petits
dictyosomes siégeant
dans la région
basale au voisinage du noyau.
Chacun
d’eux
est formé par l’empilement de quelques saccules
qu’entoure un essaim de petites vésicules
(Fig.19, 20). Ces dernières ont un contenu
osmiophile et paraissent fusionner en
granules sphériques, migrant vers le pourtour de la cavité
extracellulaire où ils
se
déchargent encore par exocytose,
comme les vésicules du
réticulum
endoplasmique. Certains des
saccules
golgiens subissent une dilatation importante et renferment
alors
un matériel d’aspect lamellaire (Fig.20,21 : flèches).
Le chondriome
est formé par des
mitochondries allongées,
légèrement
flexueuses,
pourvues de fines crêtes
parallèles (Fig.22) et se dispersant dans tout le cytoplasme.
Ce dernier renferme aussi d’autres organites :
ribosomes libres (polysomes), microfilaments
parallèles au grand axe de la cellule,
quelques lysosomes
secondaires et surtout, des inclusions feuilletées particulières issues
du matériel
lamellaire des saccules golgiens.
Ces inclusions sont des masses arrondies, compactes ou excavées,
formées par un ensemble de lamelles onduleuses très fines, superposées
concentriquement et présentant ainsi un aspect de corps «myéloïde»
ainsi nommé
car il évoque
une gaine de myéline (Fig.20
à 22). Elles se retrouvent parfois dans la cavité extracellulaire après
extrusion (Fig.22).
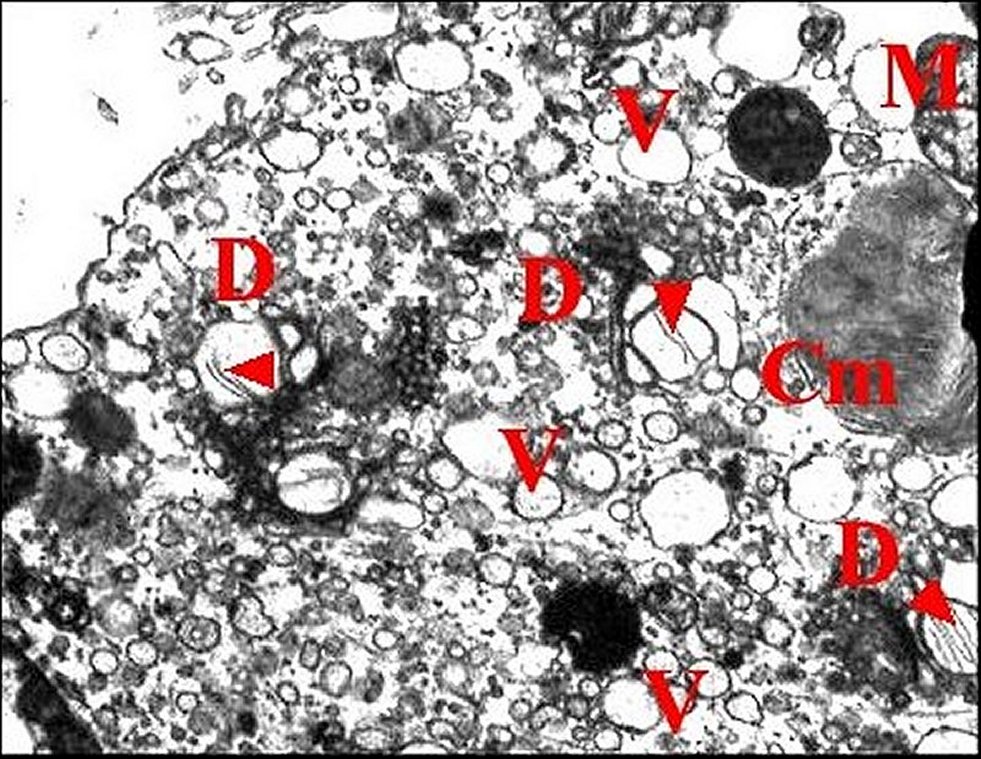 |
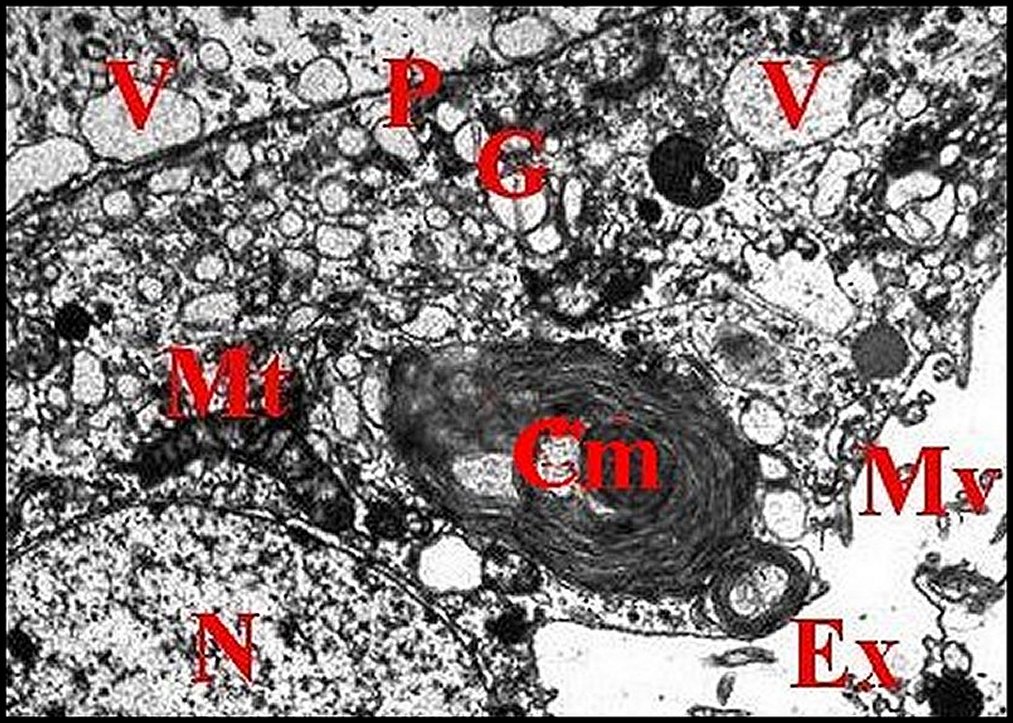 |
| Fig. 21 - Glande
rétrognathocoxale : organites
adénocytaires. |
Fig. 22 - Glande
rétrognathocoxale : organites
adénocytaires. |
| Cm, corps myéloïde - Ex, cavité extracellulaire - G, appareil de Golgi (dictyosome) - Mt, mitochondrie - Mv, microvillosités - N, noyau - P, plasmalemmes accolés - V, vésicules. Flèche rouge (Fig.21) : matériel lamellaire dans le Golgi (© A.Lopez M.E.T.) | |
Il comporte un canalicule
récepteur plongeant dans la cavité
extracellulaire de l’adénocyte
(Schéma 2,
Fig.18,23) et le canalicule
conducteur entouré par ses
cellules satellites (enveloppes ou canaliculaires) (Schéma 2,
Fig.),
tous deux ainsi nommés d’après la terminologie que Quennedey et Brossut
(1975) ont adoptée pour les glandes d’ Insectes.
Il est entièrement logé dans la cavité
extra-cellulaire de l'adénocyte,
présente quelques sinuosités
et se termine en cul-de-sac.
Sa paroi est formée par deux
couches vraisemblablement épicuticulaires
: l’une externe,
épaisse, ajourée, spongieuse,
d’aspect réticulé ; l’autre interne, beaucoup plus mince,
homogène, dense
et presque entièrement fenestrée (Fig.18,23).
Les microvillosités
adénocytaires apicales viennent s' ancrer sur la couche externe par des
hémidesmosomes (Fig.23 :
flèches), l'amarrant ainsi à la cellule
sécrétrice, tandis que
celles de la partie basale en restent séparées (Schéma
2).
La lumière
étroite peut contenir
des vésicules ou des
lamelles de corps myéloïdes
en provenance de la cavité
extracellulaire.
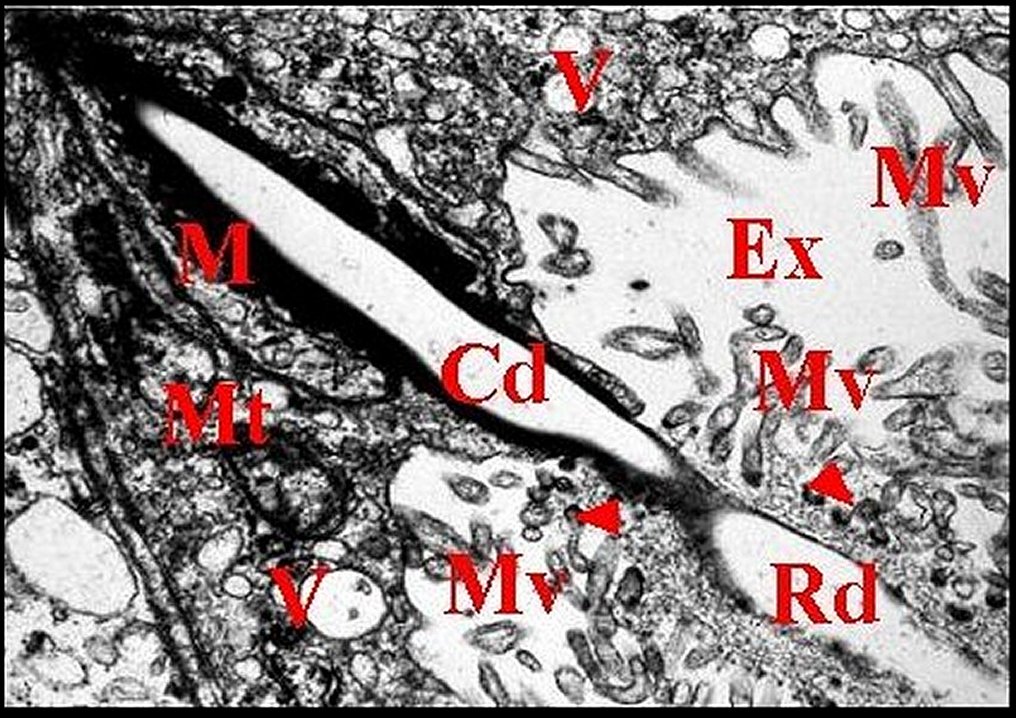 |
| Fig.
23 - Glande
rétrognathocoxale : canalicules. |
| Cd, canalicule conducteur - Ex, cavité
extracellulaire - M, matériel osmiophile - Mt, mitochondrie -
Mv, microvilli - Rd, canalicule récepteur - V, vésicules . Flèches : hémidesmosomes (© A.Lopez M.E.T.) |
.2.4.2.b-Canalicule
conducteur
Prolongement du récepteur, il a une paroi homogène, formée d'
épicuticule continue
et faisant suite à
la couche interne du précédent dont l’épaisseur
triple brusquement (Schéma
2, Fig.21,22).
Il est d’abord inclus
dans
un
«manchon» que forme l’adénocyte
en se rebroussant à
l’apex de sa cavité
extracellulaire,
ainsi fermée
de
toutes parts (Schéma 2).
Il
s’engage
ensuite dans deux cellules-enveloppes en y
décrivant un trajet
sinueux. Sa lumière est
ovalaire en section
transversale et présente un calibre régulier (diamètre
maximum :
0,3 µm).
En revanche, l’épaisseur
de sa paroi,
d’abord réduite au niveau de
la première
cellule canalaire,
augmente considérablement dans la
seconde. Cette paroi
reste lisse autour de la lumière
mais est remaniée
du côté cytoplasmique par l’adjonction remarquable d’un
matériel
abondant, très dense, osmiophile, distribué en
mottes arrondies,
plus
ou moins confluentes, conglobées et qui le bossellent
irrégulièrement
(Fig.24, Schéma 2).
Ce matériel
peut être
assimilé à de la mésocuticule car
il
semble se colorer en
rouge par la méthode de Mallory dans les coupes histologiques.
Le canalicule
conducteur et ses homologues des
unités
adjacentes convergent tous au
fond d’une dépression ou crypte
cuticulaire que
surplombe bien une languette en
auvent
de même nature.
Le
fond de cette crypte est
réduit à de l'épicuticule, l'endocuticule
s’interrompant
brusquement sur
ses parois latérales.
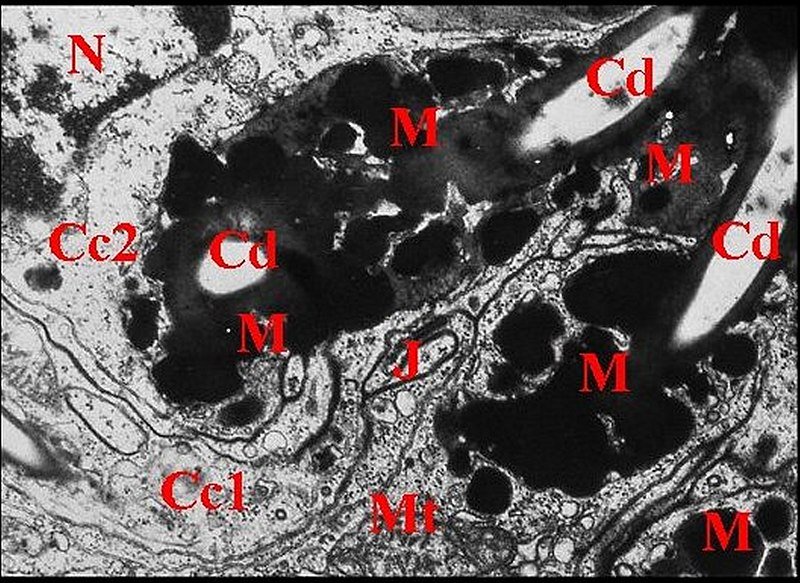 |
| Fig.
24 - Glande
rétrognathocoxale : canalicules conducteurs. |
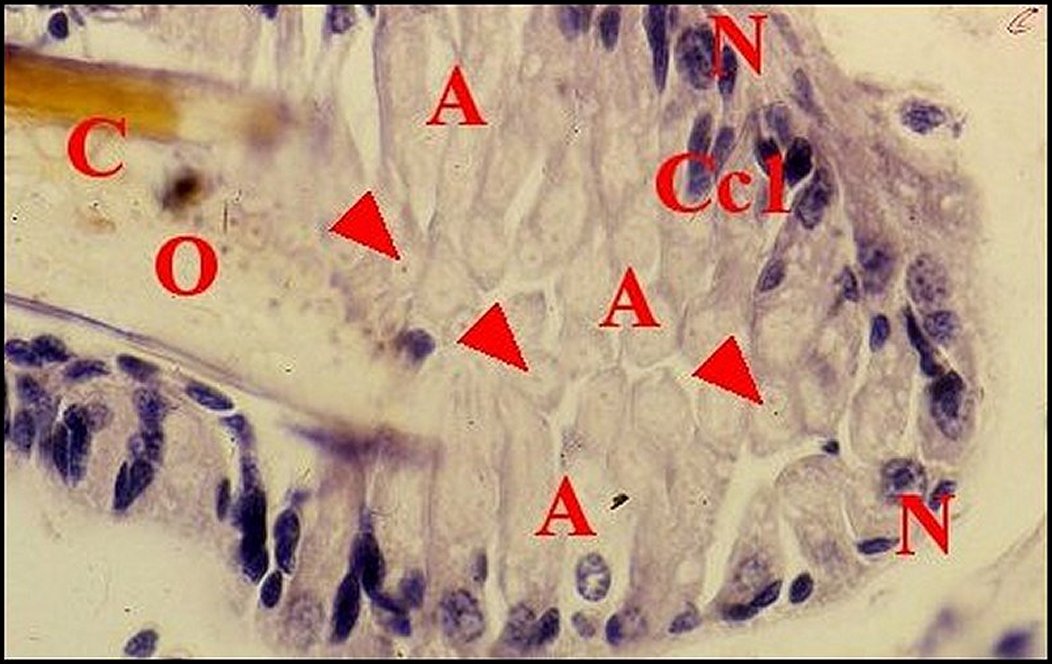
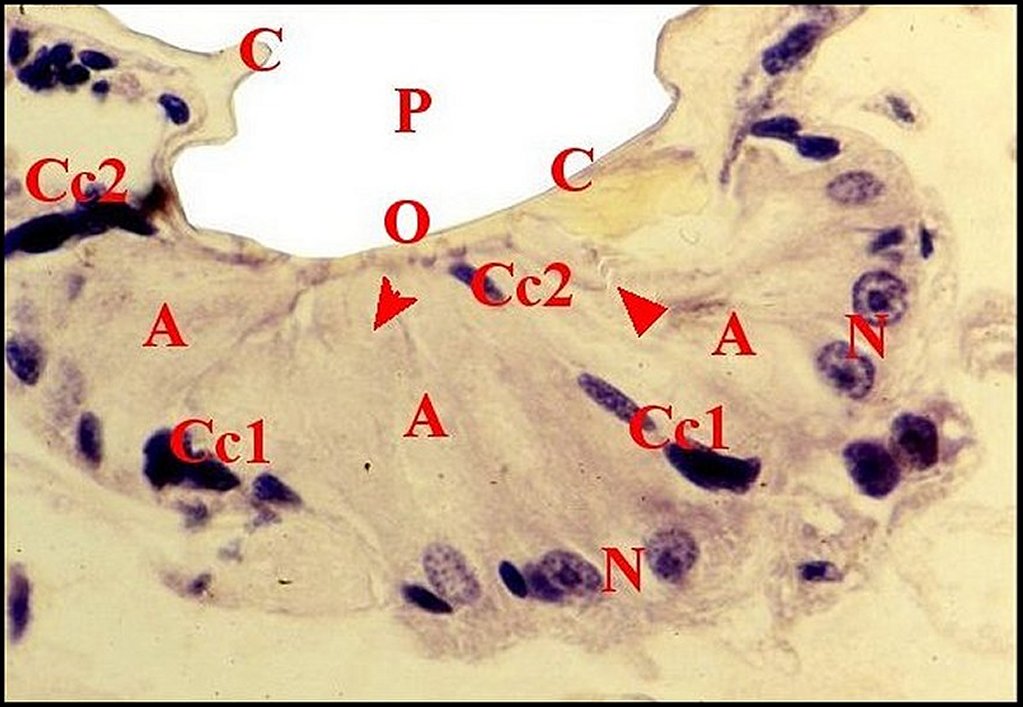
| Cc1,
cellule canaliculaire proximale -
Cc2, cellule distale - Cd, canalicule conducteur
- J, méso et desmosome - M, matériel dense - Mt, mitochondrie - N, noyau (© A.Lopez M.E.T.). |
2.4.2.c-
Cellules
canaliculaires ou cellules-enveloppes
Les deux
cellules
canaliculaires faisant partie de chaque unité
fonctionnelle peuvent être qualifiées de proximale
et distale.
Elles accompagnent le canalicule
conducteur depuis
l'adénocyte jusqu'à sa
terminaison.
La cellule
proximale repose directement sur l'adénocyte,
lui est unie par un desmosome
zonaire et
des
jonctions septées mais le
sépare d'une
grande
partie des autres cellules
sécrétrices en
émettant des expansions
cytoplasmiques aplaties.
La cellule
distale surmonte la précédente et englobe le conduit jusqu'à son
ouverture dans la crypte
cuticulaire (Schéma
2). Elle entre en rapport avec les cellules
épidermiques voisines.
Ces deux cellules
canaliculaires sont trés allongées et ont des contours
irréguliers.
Leur noyau,
seul visible dans les coupes histologiques, se situe près du
canalicule conducteur (cellule
distale) (Fig.24) ou, au contraire, s'en
éloigne beaucoup (cellule
proximale) (Schéma 2).
Généralement ovoïde, il peut être aussi incurvé ou anguleux.
Sa chromatine abondante
forme des
mottes périphériques compactes et son nucléole
est également
trés dense.
Le
cytoplasme
est réduit, surtout dans le cas de la cellule
distale, et dépourvu de toute activité sécrétoire. Il contient
quelques vésicules de réticulum,
des ribosomes
libres, des microtubules
et des microfilaments
parallèles au grand axe
cellulaire.
Chaque cellule
entoure le conduit comme
un manchon et
se referme
sur elle-même, déterminant ainsi l'apparition d'un méso. Ce dernier est
complété
par un desmosome qui se
situe à un niveau variable
entre les faces affrontées de la cellule
canaliculaire (Fig. 24).
Recherchée seule
dans un grand nombre familles,
la glande segmentaire rétrognathocoxale
peut être très réduite (Agelenidae,
Pisauridae). Ses adénocytes sont alors logés
entièrement dans l'épaisseur de l'épiderme
qu'ils ne
bossèlent pas et tendent à se disperser entre les cellules épithéliales.
3 -
Commentaires
3-1
- Au point de vue anatomique,
les organes segmentaires du
céphalothorax sont des glandes exocrines pluricellulaires
fondamentalement semblables malgré
des différences de
taille,
de nombre et, plus accessoirement, de forme.
Elles entrent dans le cadre des glandes tégumentaires anatomiquement définies au sens de Noirot et Quennedey (1974,1991) et constituées, si l’on en juge par l’ultrastructure de l’organe rétro-gnathocoxal, d’unités fonctionnelles identiques dont l'adénocyte se rattache à la classe 3 telle que les deux précédents auteurs l’ont conçue pour les Insectes.
Selon toute vraisemblance,
l’ultrastructure
des autres glandes segmentaires
prosomatiques doit être semblable à celle de l’organe rétro-gnathocoxal
car
leur aspect
histologique est strictement identique.
Il est à noter que l’ «organe
pharyngien »
de
Millot
(1936),
voisin de la paire-basirostrale
(3)(fig.25), lui ressemble
étrangement par
son aspect histologique, surtout chez les Oecobiidae
(Uroctea
durandi) (Fig.
23 à 25), et probablement
aussi par sa structure fine. Il
ne peut plus être
considéré
comme sensoriel, présente en effet dans les coupes un même
aspect de glande
épidermique
anatomiquement définie
comportant des adénocytes de
classe
3 (avec appareil terminal voir fig.1), canalicules
récepteur, conducteur
et cellules-enveloppes ou canalaires
(Lopez,1984).
Certains
des
caractères ultrastructuraux sont particulièrement frappants dans la
localisation rétro-gnathocoxale :
►Trés grande taille possible de la cavité extracellulaire en réservoir, ce qui pourrait traduire un état fonctionnel particulier et correspondrait à un stade donné du cycle sécrétoire, la même cavité devenant presque virtuelle dans d’autres étapes.
►rapports très étroits entre certaines
des microvilli et le canalicule récepteur, cette
cohésion pouvant
empêcher des déplacements excessifs du canalicule lorsque
le réservoir change de volume, et
faciliter aussi un transfert de
substances à partir du cytoplasme.
►richesse de l’adénocyte en reticulum endoplasmique et surtout en dictyosomes témoignant d’une activité sécrétoire intense. Ce Golgi présente un aspect particulier qui rappelle celui de la glande mandibulaire de Blaberus(Insectes Dictyoptères) (Quennedey & Brossut,1975).
►présence remarquable de corps myéloïdes, ici d’origine golgienne. Ces inclusions paraissent absentes dans toutes les autres glandes d’ Araignées mais ont été souvent décrits chez les Insectes, dans des organes tégumentaires aussi variés que les taxons zoologiques auxquels ils appartiennent :
∙la spermathèque du Thysanoure Thermobia domestica (Bitsch,1981)
∙la glande labrale de l 'Isoptère Schedorhinotermes (Quennedey,1975)
∙les glandes mandibulaires et tergales des Dictyoptères Blattaria (Quennedey & Brossut,1975 ; Brossut & al., 1975 ; Sreng,1979)
∙les glandes à phéromones du Névroptère Chrysopa perla (Wattebled & al.,1978)
∙les glandes défensives pygidiales des Coléoptères Carabides Brachinus crepitans (Schnepf & al.,1969) et Pterostichus madidus (Forsyth,1970), Ténébrionide Eleodes longicollis (Eisner & al., 1964)
∙les glandes mandibulaires de l’Hyménoptère Bombus (Stein,1962)
∙les glandes de Dufour et les glandes de marquage territorial des Hyménoptères Formicoidea (Bazire-Benazet & Zylberberg,1979 ; Billen,1986)
Ces corps (inclusions) myéloïdes ou multilamellaires pourraient avoir une fonction lysosomale et être ainsi impliqués dans l’autophagie cellulaire, mais représenter également des figures de sécrétion. Leur passage vers les canalicules récepteurs rappelle d’ailleurs l’observation de Sreng (1979) sur les glandes tergales de Blatella.
Les images
particulières que crée le
dépôt
localisé d’un matériel
dense au contact des canalicules
conducteurs
n’ont été observées chez aucune
autre
Araignée ou Insecte adulte.
Tout au plus évoquent-elles
certains aspects de la spermathèque en formation chez la nymphe du Coléoptère
Tenebrio molitor (Happ
&
Happ,1970).
3-2 La nature chimique de la sécrétion rétrognathocoxale, et donc segmentaire, parait encore inconnue, l’étude ultrastructurale ne fournissant pas de renseignement décisif sur la compétence biosynthétique des adénocytes.
Il
s’agit
vraisemblablement d’un produit complexe, peut être comme dans certaines
glandes exocrines de Blattes
(Brossut
& Steng,1985). La sécrétion rétrognathocoxale de Leptyphantes
paraît consister en un mélange du contenu
des vésicules
du réticulum, de celui – plus
dense- des petites vésicules
golgiennes, de vésicules
réticulaires
libérées in toto et de corps
myéloïdes. Ces derniers, de
nature lipidique ou glycoproteinique
comme Noirot et
Quennedey (1974) l’ont envisagé chez les Insectes,
pourraient être beaucoup plus nombreux encore à un autre stade
sécrétoire et correspondre alors à une phase de «stockage» comme dans
les vésicules à phéromones du mâle de Chrysopa (Wattebled
& al., 1978).
3-3 - Au
point de vue fonctionnel, le rôle joué par la sécrétion
rétrognathocoxale ne peut donner lieu qu'à des conjectures car la
région prosomatique où elle
est émise n'a jamais attiré l'attention des éthologistes par un trait
comportemental qui la mettrait en jeu. Il en est de même pour les autres
glandes segmentaires
céphalothoraciques, enfouies dans des replis peu accessibles.
Une fonction lubrificatrice paraît peu
plausible à ce niveau.
En
revanche, si l’on tient compte des seuls
caractères ultrastructuraux,
il paraît
logique d’envisager une élaboration de sémiochimiques par comparaison
avec les glandes tégumentaires des Insectes : allomones
ou, plus vraisemblablement, substances
à action phéromonale.
Le fait que
les glandes
segmentaires existent déjà chez les immatures et sont semblables
chez
le mâle et la femelle adultes n’est pas en faveur de leur intervention
dans la vie sexuelle.
Nous
pourrions plutôt admettre
qu’elles entrent en jeu dans la reconnaissance intra-spécifique.
3-4 -Au point de vue ontogénique, les glandes segmentaires présentent un intérêt majeur car du fait de leur emplacement, elles confirment et précisent la segmentation originelle fondamentale du prosoma, surtout dans sa partie céphalique.
On
sait en effet que la métamérisation et les appendices de la région
antérieure du céphalothorax aranéidien suscitent des problèmes ardus,
déjà abordés par
l’étude
du développement embryonnaire,
des sacs coelomiques, de
l’innervation
et de la musculature
(Legendre, 1959) mais non
définitivement résolus (Legendre,
1971). Une
approche nouvelle
peut en être tentée par le biais des glandes « coxales sensu
lato »
qui
apparaissent comme le rappel d’une segmentation primitive dont elles
sont les témoins fidèles.
Comme
dans le cas de la glande acronale (ex clypéale),
il est encore prématuré d’émettre une hypothèse sur les rapports de la première paire (1) avec l’acron tant
sa
réduction en rend
l’étude délicate.
En revanche, les 3 assurent
un
statut
d’appendices « complets » aux chélicères
dont le somite est
ainsi mieux
individualisé par ses glandes basales métamériques.
L’existence
des 3
à
la base
du
rostre confirme
la dualité de cet
organe, djà évoquée à propos de sa glande
rostrale
fondamentalement paire, ainsi que la nature appendiculaire des
ébauches parabuccales se rejoignant en avant
de la bouche pour lui donner
naissance. L’organe
pharyngien adjacent
pourrait lui aussi
en
être un témoignage.
Les deux derniers
couples de glandes, 4
et 5, appartiennent au
somite du pédipalpe,
territoire sensé
résulter de la fusion de deux ébauches : le segment pédipalpaire
proprement dit et le « segment fugace »
de Legendre (1959,1971).
Cette
interprétation se trouve donc sérieusement
corroborée par les
rapports que chaque lame
maxillaire contracte avec les deux glandes
« coxales sensu
lato » qui
lui
sont rattachées.
Il est intéressant
de rappeler enfin ici que d’autres glandes tégumentaires
présentant un aspect
histologique voisin et les mêmes composants ultrastructuraux unitaires (adénocytes
de classe 3, appareil
cuticulaire) siègent ailleurs dans le
corps de l’Araignée :
plastron
céphalothoracique, avec la glande
labiosternale des
Theridiosomatidae, mais
surtout dans l’abdomen donc
cette fois à distance
du prosoma.
En effet, et comme Lopez (1986) l’a souligné lors d’un congrés ,
elles se rencontrent dans la région
pédiculaire, partie la plus
antérieure
de l’opisthosoma, dans
les atria respiratoires
(trachées et poumons), dans la région
épigastrique ou génitale des deux sexes (épigyne femelle,
«épiandre» du
mâle avec
son appareil
épigastrique)
et jusque dans la base des
filières où débouchent
les glandes séricigènes.
Toutes ces glandes ne sont
pas dispersées au
hasard dans l’épiderme
mais ont une
localisation caractéristique bien particulière : ventrale,
généralement bilatérale, donc
paire, et symétrique qui n’est pas sans
rappeler certaines structures des Palpigrades («glandes
latérales» :
Millot,1942) et des Pseudoscorpions (Heurtault,
com.pers.).
Comme les organes
segmentaires prosomatiques, elles
sont à l’évidence métamériques, probablement aussi appendiculaires et
pourraient donc se rattacher aux
précédents en un seul et même ensemble anatomique.
Note 1 : Laboratoire CNRS, Moulis 09200 : fixation des parties étudiées au glutaraldéhyde à 2,9% dans le tampon Millonig 0,2 M), post-fixation au tétroxyde d’osmium à 0,2% dans le même tampon, et inclusion en épon ; coupes fines au microtome Reichert OM U2 contrastées par l’acétate d’uranyle, le citrate de plomb et examinées ensuite sous 50 KV, au microscope Sopelem du Laboratoire souterrain (Microscopie électronique à transmission : M.E.T.).
LIENS EXTERNES
http://docplayer.fr/78258899-Les-glandes-segmentaires-retro-gnathocoxales-de-leptyphantes-sanctivincentii-simon-1872-araneae-linyphiidae-structure-et-ul-trastructure.html
https://www.european-arachnology.org/esa/wp-content/uploads/2015/08/343-353_Lopez.pdf
https://pt.frwiki.wiki/wiki/Glandes_segmentaires
Bibliographie
Bazire-Benazet, M. & L.Zylberberg, 1979.- J. Insect Physiol.,25, p ;751-765.
Billen,
J.P.J.,1986.- Entomol.Gener.,
11 (3/4), p.165-181.
Bitsch,
J.,1981.-
Int.J. Insect Mophol. and Embryol., 10 (3), p.247-263.
Brossut,R.,Dubois,P.,Rigaud,J. & L.Sreng,1975.- Insect Biochem.,5, p ;719-732.
Brossut,L. & L.Sreng,1985.- Bull.Soc.ent.France,90, p.1266-1280.
Eisner, T., Mc Henry,F. & M.M. Salpeter,1964.- J.Morph., 115 (3), p.355-368.
Forsyth,D.J.,1970.- J.Morph., 131, p.
397-417.
Happ,
G.M. &
C.M. Happ,1970.-
Tissue Cell,2, p.443-466.
Legendre,
R., 1959.-
Ann.Sci.nat, Zool. et Biol.animale, 12, p. 339-473.
Legendre,R.,1971
.- C.R.Ve
Congr.Inter.Arachn. ,
Brno, Tchécoslovaquie,1971, p. 183-187.
Lopez,A.,1978.(avec R.Legendre).- C.R.Acad.Sci., Paris,286, D, p.407-409.
Lopez,A.1983.
– The Journal of Arachnology (USA), 11, p. 97-98.
Lopez,A.,1984.-
Revue Arachnologique, 5(4), 1984, : 343-354.
Lopez,A.,1988
(avec L.Juberthie-Jupeau).- C.R.Xe Coll.europ. Arachnol.,
Bull.Soc.sci.Bretagne, 59, n° h.s.I, p.115-129.
Lopez,A.,1986
(avec
M.Emerit) – Acta X Congr.Int.Aracnol. Jaca/España, 1986. II : 25-40.
Lopez,
A.,1993 - Les Araignées de la Guadeloupe : genres Metepeira, Cyclosa et Argiope (Araneidae).
Bull.Soc.Sciences Nat., n°77, p. 9-16.
Millot,J.,1936.-
Bull.Soc.zool.France,
61, p.27-38.
Millot,J.,1942.-
Rev.franç.Entom.,9,
p.127-135.
Noirot,C.
& A.
Quennedey.,1974.- Ann.Rev.Ent., 169, p.61-80.
Noirot,C.
& A.
Quennedey., 1991.- Annls Soc.ent.Fr. (N.S.), 1991, 27 (2), p.123-128.
Quennedey,
A.,1975.- Cell.Tiss.Res.,160,
p.81-98.
Quennedey,A.
& R.Brossut,1975.- Tissue
Cell, 7 (3), p.503-517.
Schnepf,E.,
Wenneis,W. & H. Schildknecht,
1969.- Z.Zellforsch.mikrosk.Anat.,96,
p.582-599.
Sreng,L.,1979.-
J.
Insect.Morphol.Embryol.,8,p.213-227.
Stein,G.,1962.-
Z.Zellforsch.,57,
p.719-736.
Wattebled,S.,Bitsch.,J.
&
A.Rousset,
1978.- Cell.Tiss.Res.,194,
p.481-496.