|
Obturateurs génitaux en particulier chez les Argyrodes ANATOMIE DES ARAIGNEES : VINGT-CINQ ANS DE RECHERCHES |
|
Après l'accouplement, l'appareil génital des Araignées femelles est parfois oblitéré, notamment chez les Argyrodes (Théridiidae) et certaines Araneidae par une substance amorphe ou une partie du palpe mâle ("mating plug") rendant impossible une nouvelle copulation |
| Abréviations et Couleurs conventionnelles |
|
M.E.B. :
(photographie
en) microscopie électronique à balayage
C.H.
: coupe histologique (microscopie photonique)
|
1 - Introduction
L'orifice génital primaire ou gonopore
des araignées femelles s'ouvre, comme celui des mâles, au
milieu de la fente ou sillon épigastrique marquant la limite
entre les 2èmes et 3émes somites
abdominaux (opisthosomiens(Schémas 1,2).
Très simple chez
les mâles, où il ne présente que les
différenciations
superficielles de l' appareil
épigastrique,
il est également unique et banal chez les femelles de
certains
groupes “primitifs” (Araignées dites “Haplogynes” et
Orthognathes/ Liphistiomorphes, Mygalomorphes,Filistatidae, Dysderidae,
Sicariidae).
Chez les
autres
(« Entélégynes »), l’orifice
génital est en revanche surmonté par un organe copulateur
spécialisé,
l’épigyne, plaque chitineuse dont la forme en auvent,
l’ornementation
et l’épaisseur varient avec les espèces. Cette épigyne
est ainsi d’une diversité aussi extraordinaire que celle de l’organe copulateur mâle.
Son
maximum de complexité se rencontre dans des familles
“privilégiées”
((Araneidae, Linyphiidae) où elle porte un scape en forme de
coquille et un appendice médian unciforme,
dispositifs immobilisant le bulbe du mâle lors de la
copulation comme chez Leptyphantes.
A l’orifice
génital ou gonopore (Gp, G) fait suite un uterus
externus
(U,Ue) dans lequel certains auteurs tels que Millot (1968) ont
distingué
un vagin et un uterus. Cet appareil , impair et
médian, reçoit deux oviductes (T) qui prolongent
eux-mêmes les
ovaires (Ov) (Fig.1).
|
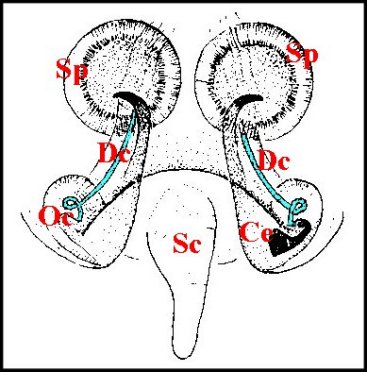
|
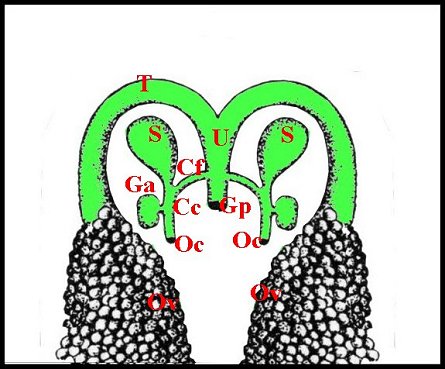
Schéma
1- Appareil génital femelle, vue d'ensemble
|
| Cc,
canal
de copulation ; Cf, canal de fécondation ; Ga, glande annexe ;
Gp,
gonopore ; Oc, orifice de copulation ; Ov, ovaire ; S,
spermathèque
; T, oviducte ; U, uterus externus ; |
Il est complété par des
annexes
: une, généralement deux ou un plus grand nombre de
spermathèques
(réservoirs spermatiques)(S) munies de glandes annexes,
débouchant
dans l’uterus externus soit directement comme des diverticules (cas le
plus
simple : “Haplogynes”), soit par l’intermédiaire de deux
conduits efférents très courts, les canaux de
fécondation ou de fertilisation.
Dans ce deuxième cas, le plus complexe mais aussi le plus
fréquent
(“Entélégynes”), les spermathèques sont
également reliées par deux conduits afférents plus
ou moins longs et contournés,
les canaux de copulation (Cc) à deux orifices
“supplémentaires”dits
aussi de copulation (Oc). Les conduits et les
spermathèques,
tous pourvus d’un revêtement chitineux, sont inclus dans
l’épigyne.
Les orifices de copulation (Oc) flanquent l’orifice génital impair
(Gp,G),
tous trois s'ouvrant alors dans un sillon devenu largement
béant,
l’ atrium génital (A),
que
peuvent encore compliquer des poches copulatrices annexes
spécialisées,
avec des glandes (Ga) (Fig.
2,3).
|
|
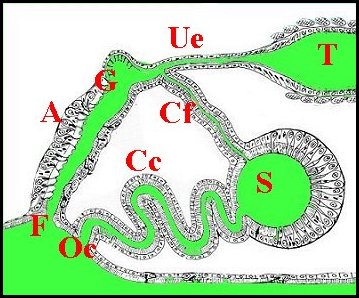
Schéma 2 - Appareil génital
femelle en coupe histologique
|
| Cc, canal de copulation ; Cf, canal de fécondation ; Ga, glande annexe ; Gp, gonopore ; Oc, orifice de copulation ;Ov, ovaire ; S, spermathèque ; T,oviducte Ue, uterus externus ; |
L’ensemble
de cet appareil génital femelle (genitalia) est largement
utilisé
par les systématiciens qui l’isolent et le préparent
comme
les palpes mâles pour compléter la description de toute
espèce
d’Araignée.
Ses
deux grands dispositifs anatomiques sont responsables de deux
traitements différents des gamètes. Chez les
“Haplogynes” et les
Orthognathes, l’uterus externus est
à la fois
le
lieu de la copulation et de la fécondation des œufs. En
revanche,
les deux processus sont nettement séparés chez les
Entélégynes
: lors de l’accouplement, l’embolus
mâle
est inséré par l’orifice de copulation dans
le
canal homonyme, parfois même, lorsqu’il est
très
long, jusqu’à la spermathèque où sont
déposés
directement les gamètes.
Or,
depuis les premières observations de Blackwall (1877) et de
Pickard-Cambridge
(1880), divers zoologistes ont remarqué que la région
génitale
de certaines femelles
d’Araignées était recouverte
par
une
“substance” étangère ou contenait des fragments
de
palpes mâles.
La
première a été désignée sous les
noms de “bouchon épigynal” ( Levi, 1977a : “epigynal
plug”) ou de “bouchon
d’accouplement” (Jackson, 1980 ; Yoshikura, 1982), ce dernier
(“mating
plug”)
traduisant mieux le rapport du matériel étranger avec la
copulation. Je préfère pour ma part
les
désigner sous
l’ appellation unique d’ obturateurs génitaux.
2 - Obturateur structuré ou obturateur embolique
Certaines parties du pédipalpe mâle peuvent rester incluses
dans
les genitalia de
la femelle après l’ accouplement (Araneidae, Oxyopidae,
Theridiidae). On sait que le segment distal du style ou embolus
(Fig.1,2,3) en est la portion intromittente).
 |
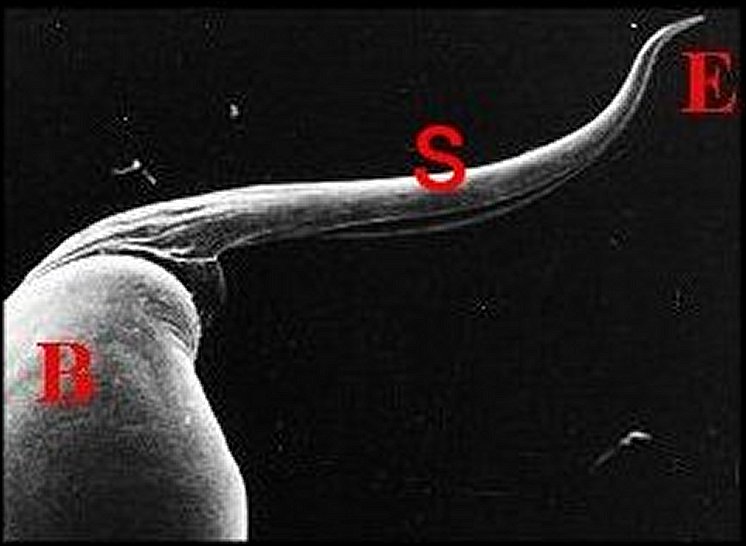 |
 |
| Fig.1 - Anelosimus
eximius,
Guyane |
Fig. 2 -Nephila inaurata
inaurata,
Réunion |
Fig.3 -Dysdera sp.(?) |
|
Emboli
ou styles de trois araignées mâles
B,
reste du bulbe ; E, partie terminale du style ou embolus (© A.Lopez
M.E.B.)
|
||
Pendant la copulation, ce segment s’enfonce
et se brise, soit dans le canal de copulation, soit dans la spermathèque où il se trouve en quelque sorte
« incarcéré ».
Les deux emboli
peuvent être
affectés
lors de leur insertion simultanée ou successive et se trouvent
ainsi
groupés dans un canal de copulation ou dans les deux. Les
mâles
amputés deviendraient presque toujours incapables d’un
accouplement ultérieur avec leur(s) pédipalpe (s), au point
d’avoir été baptisés
“ eunuques ” par
Robinson et Robinson (1980).
Dans d’ autres cas, l' embolus ne subit pas de rupture apicale, mais
il
s’en détache à la copulation une "coiffe embolique" préformée. Ce
curieux
petit étui ou capuchon terminal préexiste chez
les mâles vierges qui le conservent, en principe,
s’ils ne s ‘accouplent pas. Levi (1970,1975) l’a décrit et
interprété ("embolus
cap") chez plusieurs genres d'Araneinae (Araneidae) dont les femelles
fécondées
renferment ainsi des "coiffes"' dans leurs genitalia (Schémas 3 : Ce).
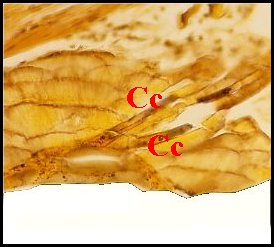
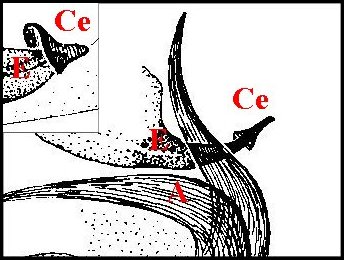 |
 |
| Schémas 3-- Coiffe embolique (Ce) de Metepeira | |
|
Sur l'embolus (E) d'un mâle vierge
à
gauche, et dans le canal de copulation(Oc) d'une femelle
tout
à droite
|
|
Deux coiffes peuvent se
retrouver d’ailleurs chez un même
individu comme les extrémités d’embolus. Fait
curieux, j’ai observé que certainsde ces mêmes genres sont
dépourvus de dimorphisme
sexuel salivaire (Lopez,1986b).
En revanche, les
mâles d’Araneinae qui possèdent des glandes gnathocoxales spécialisées,
dites
« sexuelles » (Lopez,1977b) montrent
un
embolus sans coiffe et qui ne subit pas de rupture apicale lors de
la copulation. Ces mâles peuvent donc s’accoupler à
nouveau
ultérieurement et utilisent la sécrétion des
mêmes
glandes pour « lubrifier » leurs palpes,
facilitant
ainsi des intromissions répétées.
Les parties rompues ou
détachables de
l’embolus
sont formées par de la chitine avec son épicuticule et
son
endocuticule lamellaire. Il s’ensuit que les deux parties de bulbe
(embolus) ainsi constituées peuvent être
qualifiées d’ « obturateur
structuré »
ou « embolique ».
3 - Obturateur non structuré ou sécrétoire
Le
“Bouchon d’accouplement” (“Mating plug”) classique peut être défini
comme
une substance recouvrant les orifices de copulation et
l’épigyne
d’ Araignées femelles s’étant apariées. Elle
est
toujours absente chez les femelles vierges des espèces
concernées.
Les « bouchons » varient de l’un à
l’autre
et même, pour certains caractères, dans un même
« plug »
par :
►leur taille (pellicule très mince à masse volumineuse),
►leur forme (coin, masse amorphe ou sculptée, masse unique ou dédoublée), que cette disposition soit ou non nsymétrique,
►leur couleur (blanche, jaune, orange, rouge),
►leur texture (lisse et brillante ou granuleuse).
Les deux
orifices
de copulation et la zone qui les sépare en sont couverts mais le
gonopore ou orifice génital primaire reste toujours libre. Les « bouchons »
ont
été signalés chez les Salticidae, Clubionidae, Araneidae, (dont Cyclosa), Oxyopidae, Thomisidae, Toxopidae et Theridiidae.
Dans cette dernière famille, le
genre
Argyrodes est privilégié comme à
d’autres
égards (glande acronale
ou
clypéale). Décrivant Argyrodes cognatus (îles
Seychelles), Blackwall (1877) soulignait que les organes sexuels de
cette « Epeira cognata » sont
très développés,
proéminents, asymétriques et montrent une saillie
incurvée
en “ crosse ” (pl.2, fig.12) (Fig.6 : G). Cambridge, dans une
note
jointe et plus tard encore (1880, p.326) souligne que cet
« appendice sexuel anormal » résulte
en fait de l’adhérence
accidentelle d’une petite particule de matière
“résineuse”
de même couleur, certainement “ adventice ”,
formée,
formée par une « exsudation de cause et nature
inconnues ».
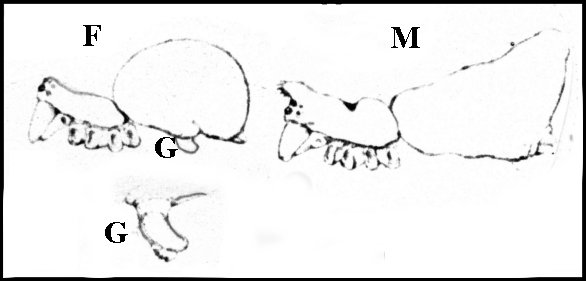 |
 |
|
Schéma
5 - Argyrodes
cognatus, vue
latérale
gauche
(d'après Blackwall,1877)
|
Fig.4 - Argyrodes
chounguii Lopez, Mayotte. Femelle préparée, vue
latérale droite |
| F, femelle ; G, "appendice sexuel anormal" ; M, mâle | Flèche : obturateur |
Il le signale aussi chez
Argyrodes argentatus (processus rouge transparent, brillant,de
nature
« résineuse ») et chez A. procrastinans (gros, arrondi, proéminent, de
couleur
brun-rouge, très brillant, en forme de capuchon recouvrant
l’ouverture
génitale).
Bien plus tard, Exline et
Levi (1962) décrivent
l’épigyne des Argyrodes femelles comme une
plaque sclérifiée souvent
recouverte par un matériel “ résineux ”
difficile
à enlever.
J’ai pu également constater dans mon propre matériel, d’origines géographiques très diverses, que les femelles adultes des Argyrodes sont bien sujettes à l’adjonction d’une substance donnant un aspect « anormal » à leur aire génitale, oblitérant sa structure réelle (“ disfigurment ”) et diminuant beaucoup la valeur de l’épigyne comme critère de distinction spécifique.
Pour les
recherches histologiques et ultrastructurales (au M.E.B. seulement :
Note1), j’ai surtout utilisé la
belle espèce « historique » Argyrodes
cognatus (Blackwall)
(Mahé, Seychelles : Lopez col.) et en décrit
par
ailleurs la glande acronale.
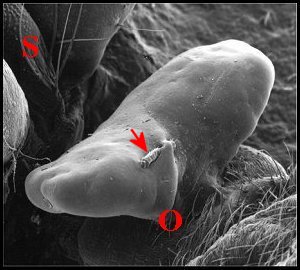
3.1 - Aspect au M.E.B.
Le « bouchon » fait largement saillie au-dessus
de
la région génitale femelle. Il s’y présente comme
une
masse volumineuse, nettement bilobée, paraissant aussi
pédiculisée
(Fig.4,5), rappelant quelque peu (la Sacculine (Crustacé
Cirripède)
insérée sur l’abdomen d’un crabe et est aussi
spectaculaire,
à échelle plus réduite, que le sphragis d’un Lépidoptère
Parnassiine !.
Les deux "lobes" sont inégaux, asymétriques,
orientés
transversalement et ont une surface mamelonnée, lisse,
sans
sculpture évidente . Le « pied » se
fond dans le sillon épigastrique où il s'étale en
"socle"
au niveau des orifices de copulation. L'un des "bouchons"
examinés
renfermait un "corps étranger" aciculaire pouvant provenir du
mâle
(palpe ?).
 |
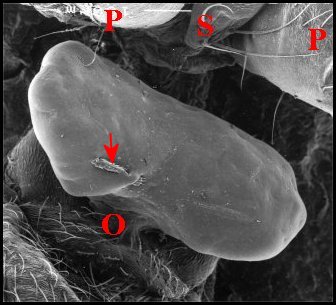 |
| Fig.7.- Deux vues d'un obturateur d'Argyrodes cognatus (M.E.B.) | |
| O, zone des orifices de copulation ; P, patte arrière ; S, sternum . Flèches : "corps étranger" (© A.Lopez M.E.B.) | |
3.2 - Histologie
Dans les coupes histologiques (para)sagittales, le « bouchon gonoporal » (« mating plug ») (Fig.8) parait formé par une substance inorganisée, presque homogène, un peu craquelée en "écailles" (artéfact technique ?). Elle a une coloration naturelle jaunâtre rappelant celle de la cuticule et est légèrement APS +. Sous le socle, elle pénètre dans les canaux de copulation qu’elle semble injecter en les obturant. Bien différente de l’obturateur structuré embolique, elle présente sans équivoque l’aspect d’une sécrétion coagulée et durcie, aussi bien dans sa partie externe saillante que dans celle qui emplit les canaux de copulation. Ce matériel ne peut provenir de la femelle ; il a donc été sécrété par le mâle qui l’a apposé et injecté. Un tel dispositif peut ainsi être qualifiée d’ « obturateur non structuré » ou « "sécrétoire».
|
|
|
|
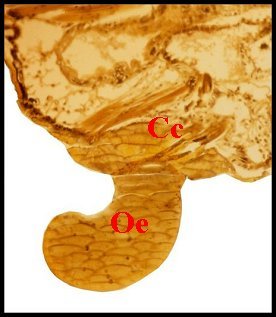
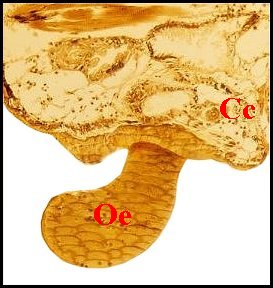
| Fig.8 - Argyrodes cognatus femelle, obturateur |
||
|
Obturateur d' Argyrodes
cognatus
: coupes histologiques totales ( à gauche, au centre) et
partielle
(à droite) Cc, canaux de copulation
injectés
; Oe, partie externe
|
||
3 - Commentaires
Sur le plan anatomique,
les
obturateurs génitaux se présentent comme de
véritables
« corps étrangers » inclus dans
l’opisthosoma
femelle.
Il peut s’agir d’une partie du
palpe
mâle, plus précisément de son bulbe, soit
l’extrémité
rompue de l’embolus, soit une petite pièce
préformée
et amovible, la «coiffe embolique", désigné
ici sous le nom d’obturateur structuré ou embolique. Mais
il peut être aussi constitué d’une
sécrétion modifiée, le « mating plug » des Anglosaxons, appelé ici obturateur non structuré
ou
sécrétoire,
matériel
à surface peu ou non élaborée, amorphe,
presque
homogène, non chitineux,
Dans ce
dernier
cas, j’ai
noté
chez les Argyrodes,
genre privilégié pour les études anatomiques
(glande acronale ou
clypéale),que
l’obturateur n’est pas seulement
« collé » sur la
région
génitale de la femelle mais aussi injecté dans les canaux de copulation qqu’il moule étroitement et s’y
trouve en quelque sorte « enraciné ».
Par ailleurs,
l’origine anatomique des « bouchons » ne semblant
pas
avoir été élucidée, j’ai acquis
la conviction , d’après mes coupes histologiques, qu’ils sont
produits,
par le bulbe copulateur mâle, sinon chez toutes les
Araignées
qui en élaborent, du moins dans le cas des Argyrodes. Les glandes gnathocoxales de ces Theridiidae ne peuvent être
impliquées
dans la sécrétion car elles sont trop peu
développées et ne présentent pas un dimorphisme sexuel salivaire contrairement aux Linyphiidae . En revanche, l’épithélium du
tube
séminifère me parait être un
bien
meilleur candidat à la production de l’obturateur car il
présente
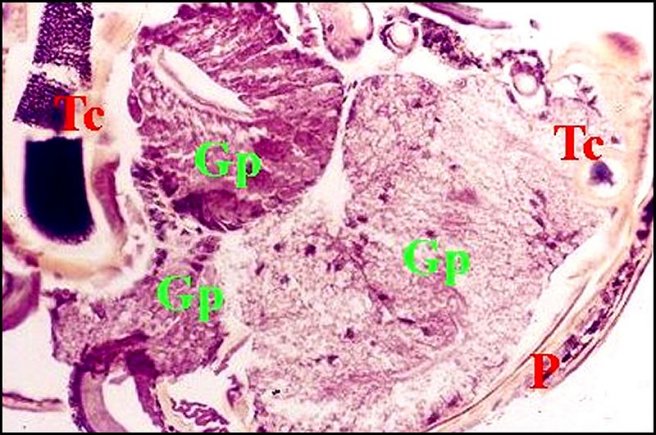
un développement considérable. La glande qu’il
édifie
(confere supra) est très complexe (Fig.9 : Gp)
et d’un volume disproportionné à celui du conduit
chitineux
(Fig. 9 : Tc) ; son rôle n’est probablement pas limité
à la seule mobilisation du sperme (induction-ejaculation secondaire).
 |
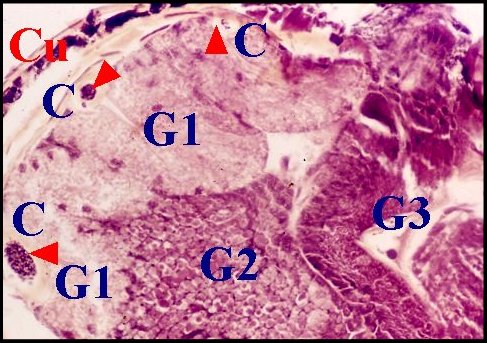 |
| Fig.9
- Argyrodes zonatus mâle, glande palpaire : deux vues
trés
partielles. |
|
| Gp, glande palpaire ; P, paroi chitineuse du bulbe ; Tc, tube chitineux et spermatozoïdes (© A.Lopez C.H.) | |
Sur le
plan fonctionnel,
il est très possible qu’ en fin d’éjaculation secondaire,
une partie de la sécrétion
de cette même glande passe dans la lumière du
réceptacle
ou du moins dans celle du canal éjaculateur par des orifices qui restent à
mettre
en évidence, alors qu’ailleurs elle en est séparée
par
l’endocuticule du tube
séminifère. Ainsi
serait-elle déposée dans les canaux de copulation
puis en surface lors du retrait, s’y coagulant ensuite pour
assumer
un rôle de blocage irréversible.
Ce dernier se trouve lié à une réduction de la fuite du sperme et surtout, à la compétition spermatique.. Jackson (1980) considère en effet que les « mating plugs » sont des adaptations formant obstacle à l'insémination par d'autres mâles. Ils représentent en effet une barrière physique, sorte de « ceinture de chasteté » (Robinson,1980 : « chastity belt ») qu’un second partenaire devrait obligatoirement extraire, peut être avec son palpe, pour pouvoir copuler en chassant le sperme du premier, manœuvre d’autant plus hasardeuse que les femelles ne tolèrent guère des copulations prolongées !.
En revanche, cet
obstacle à des inséminations
ultérieures ne doit pas être très efficace
dans
le cas des obturateurs structurés car ils sont
souvent beaucoup
plus petits que les canaux où ils se logent ; de plus, le
fait qu’ils puissent être plus de deux dans l’épigyne
d’une seule
femelle, prouve qu’ils n’ont pu empécher l’accouplement de cette
dernière
avec au moins deux mâles différents. Leur
efficacité
ne deviendrait réelle que s’ils étaient englobés
par
une matrice ou coagulum semblable à l’obturateur non
structuré.
 |
| Fig.10
- Parnassius
mnemosyne ("Semi-Apollon"), femelle fécondée
portant un sphragis (flèche), vue latérale droite.
Alefroide,Hautes
Alpes (© A.Lopez ) |
Note1 : Laboratoire de Microscopie
électronique,
Université des Sciences et Techniques du Languedoc, 34
Montpellier
: Métallisation à l'or et examen au Microscope
électronique
à balayage Siemens, avec la collaboration de L.Datas.
Bibliographie
Exline ,H. & Levi, H.W., 1962.- Bull.Mus.Comp.Zool.,Harvard, 127 (n°2) : 75 –202.
Jackson,
R.R.,
1980.- J. Arachnol., 8 : 217-240.
Levi, H.W., 1970-
Bull.Mus.nat.Hist.nat.,
41, sup.1, p.108-111.
Levi,H.W.,1975.- Proc.VI
Intern.Congr.Arachnol.,Amsterdam,
April 1974, p.49-50.
Lopez,A.,1977b. – Contribution à l’étude des caractères sexuels somatiques chez les mâles d’Aranéides. Thèse doct.Etat es. Sciences, Univ.Sci.Tech., Montpellier, Avril 1977, 117 pp.
Lopez,A.,1987a.- Glandular Aspects of Sexual
Biology in Ecophysiology of Spiders.W.Nentwig, edit.,
Springer-Verlag, p.121-132.
Lopez,A.,1986b.-
Bull.Soc.Et.Sci.nat.Béziers, ns, XI, Vol.52, 1986,p.4-11.
Millot,J. 1968.- Ordre des
Aranéides
in Traité de Zoologie,
P.P.Grassé
édit., Masson, p. 589-743.
Pickard-Cambridge, O., 1880.- Proc.Zool.Soc.London : 320-342.
Robinson, M.H. & B.Robinson, 1980. – Pacific Insects Monogr., 36, 1.