|
Bulbe copulateur et sa glande palpaire
ANATOMIE
ET COMPORTEMENT DES ARAIGNEES :
VINGT-CINQ
ANS DE RECHERCHES
(Version
2023)
Par
André LOPEZ
|
Une étrangeté majeure de l' évolutionL'organe
copulateur des Araignées mâles, hautement original, sans
équivalent dans le reste du Monde animal et d'une
incroyable
complexité sur le plan ultrastructural.
|
|
Couleurs
conventionnelles :
En noir et italiques, termes anatomiques ; en violet,,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
orange,, parties
les plus importantes
et résumés
; en bleu, liens divers.
|
|
Abréviations
conventionnelles :
M.E.B.
:
(photographie en) microscopie électronique à
balayage
M.E.T. :
(photographie en) microscopie électronique à
transmission
C.H. :
coupe histologique
(microscopie photonique)
|
1 -Généralités
2 - Histologie
2.a - Canal éjaculateur
2.b - Tube séminifère
2.b.1 - Epithélium et glande palpaire
2.b.2 - Tube chitineux
2.b.3 - Cavités et membranes pariétales
3 - Ultrastructure
3.a - Epithélium
3.a.1 - Canal éjaculateur
3.a.2 - Réservoir
3.b - Partie cuticulaire
3.b.1 - Cuticule extraglandulaire
3.b.2 - Cuticule glandulaire
3.c - Rapports de l'épithélium et de la partie cuticulaire
3.c.1 - Epithélium continu
3.c.2 - Epithélium continu avec des culs de sac
3.c.3 - Epithélium discontinu
4 - Commentaires
4.a - Point de vue anatomique
4.b - Point de vue fonctionnel
4.b.1 - Induction spermatique
4.b.2 - Ejaculation secondaire
4.c - Point de vue systématique
4.d - Point de vue phylogénique
1 - Généralités
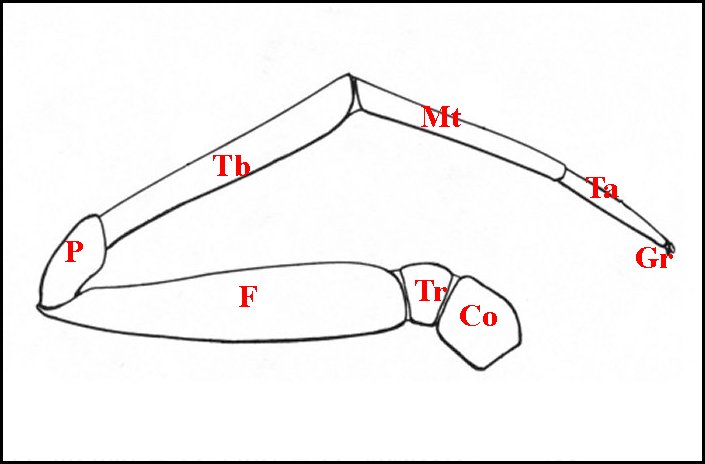
Les pédipalpes (palpes ou pattes-machoires) des Araignées représentent la deuxième paire d'appendices prosomatiques. Ils sont situés entre les chélicères (première paire) et les pattes ambulatoires (Fig.1).
 |
| Fig.1-
Theraphosa leblondi (Guyane) : femelle, vue
antéro-dorsale (© photo A.Lopez, 2004) |
|
Ch,
chélicères - F, fémur - Mt,
métatarse - P,
patella - Pd, pédipalpe - Ta, tarse de patte ambulatoire
-
Tb, tibia - Tr, trochanter .
|
Alors
que ces dernières sont formées de
7 articles (hanche ou
coxa, trochanter, fémur,
patella, tibia, métatarse
ou basitarse, tarse
avec un prétarse de 2 Ã 3 griffes), (Fig.1,Schéma
1), les
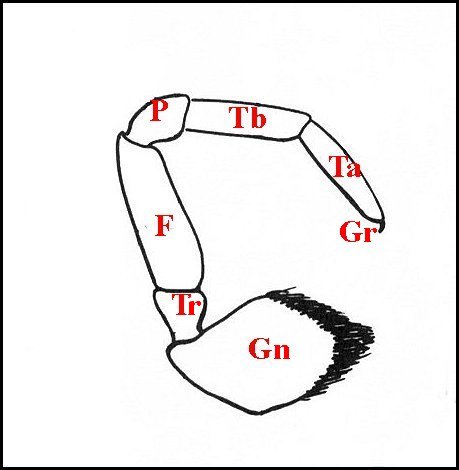
pédipalpes n'en
comportent que 6 : gnathocoxa, trochanter, fémur, patelle, tibia et
tarse muni d'1 griffe chez les
femelles seulement (Schéma 2).
 |
 |
| Schéma 1- Patte ambulatoire d'Araignée et ses articles | Schéma 2- Palpe d'Araignée femelle et ses articles |
| Co, coxa - F, fémur - Gn, gnathocoxa - Gr, griffe(s) tarsale (s) - Mt, métatarse - P, patella - Ta, tarse - Tb, tibia - Tr, trochanter | |
Chez
toutes les
Araignées mâles, et
quelle que
soit leur position systématique, les deux
pédipalpes sont
différenciés à leur
extrémité tarsale en un organe d'accouplement « hautement
original, sans équivalent direct dans les autres groupes animaux
» (Millot,1968).
Comparé
par R.Legendre à un minuscule «gant de
boxe» (terme personnel), il permet de
reconnaître
d'emblée un mâle d'Araignée,
"at a glance» (Snodgrass,1965)
(Fig.2 à 7), alors même que ce dernier
est encore immature (Figs.4,5).
 |
 |
 |
| Fig. 2 - Pholcus phalangioides, mâle : vue latérale droite (© photo A.Lopez) | Fig. 3 - Archaea
sp.,
mâle (Madagascar) : vue latérale droite, en immersion
(Don R.Legendre : photo A.Lopez) |
Fig.4 -Araniella cucurbitina, mâle immature vue ventrale (© photo A.Lopez) |
| P,
palpes avec leur renflement bulbaire caractéristique |
||
 |
|
Fig. 5 - Meta
bourneti, mâle immature,
vue latérale gauche
Flèche : palpe
(© photo A.Lopez) |
 |
 |
 |
| Fig. 6 - Tegenaria parietina, mâle
: vu de face |
Fig. 7 - Araneus sp. , mâle
: vue ventrale. |
Fig.8 - Erigone
dentipalpis, mâle
:
vue latérale gauche. |
| P, palpes avec leur renflement bulbaire caractéristique et des apophyses (Fig.7,8) (© photos A.Lopez) | ||
Sa
taille est parfois si
considérable (certains Theridiidae
tels Tidarren
fordum et Echinotheridion)
qu'il constituerait pour l'animal un « handicap
» le contraignant à amputer
l'un des deux renflements
tarsaux
avec ses chélicères
lors de l'avant-dernire mue (Chamberlin
& Ivie,1934) (Schémas
3,4).
.
 |
 |
| Schéma 3 - Tidarren
mâle à palpe unique (P) (d'après Chamberlin et Bonnet) |
Schéma
4 - Echinotheridion
mâle à palpe unique (P) (d'après Levi) |
Comme
le
prouve sa musculature, l'organe copulateur mâle n'est
autre que le segment apical (prétarse)
du pédipalpe qui a subi un
développement quasi-extravagant
alors qu'il se réduit chez la femelle à la seule griffe
palpaire (Schéma
2).
Il est
essentiellement
constituépar
un bulbe
copulateur globuleux
ou piriforme qui
s'effile à son sommet en un style ou embolus jouant le
rôle de pénis et repose
sur une alvéole du
tarse modifié
rappelant par sa
forme une «cuiller», le cymbium, que
complète parfois un
paracymbium.
Ces deux composants représentent la
quasi-totalité
de sa
structure chez les Araignées Haplogynes
et Orthognathes
(Schéma
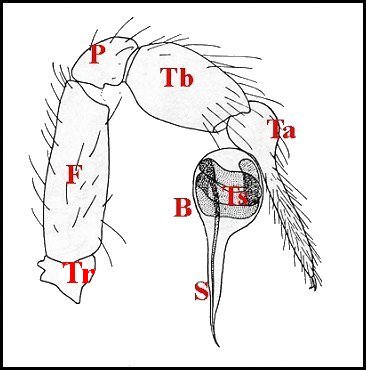
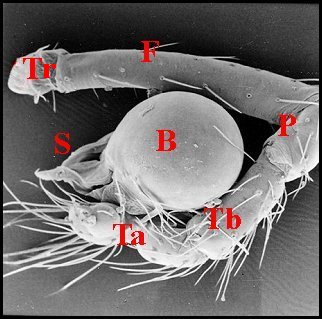
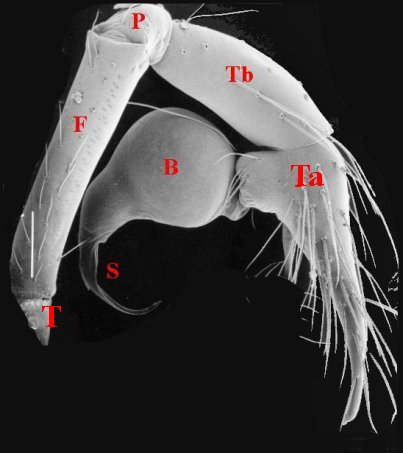
5, Fig.9 Ã 11).
 |
 |
 |
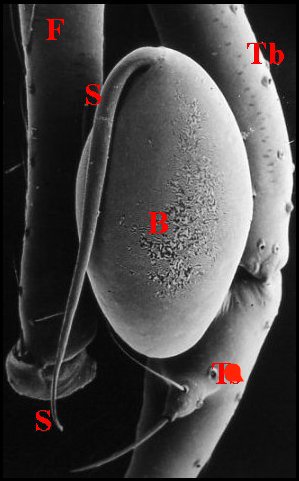 |
| Schéma
5- Aspect
général d' un palpe d'Araignée
haplogyne et
son bulbe |
Fig.9 - Leptoneta infuscata minos : palpe entier, avec bulbe. |
Fig.10-Ochyroceracaeruleoamethystina
palpe
entier, avec bulbe
|
Fig.11-Ochyrocera
thibaudi
: bulbe |
| B, bulbe et son style S - F,émur - P, patella - T (Tr), trochanter - Ta, tarse - Tb, tibia - Ts, tube séminifère (vu par transparence). Fig.9 Ã 11 : © A.Lopez M.E.B. | |||
Mais
l'organe peut être beaucoup plus complexe dans
le cas des Entélégynes
où
il comporte également des pièces chitineuses
rigides, les
sclérites,
ainsi que des parties
molles
fibro-élastiques, en coussinet extensible,
chacune appelée haematodocha. Les sclérites
ont des noms particuliers : conducteur
qui
soutient le style,
tegulum, subtegulum,
apophyses
terminale et médiane,
stipes,
radix auxquels
s'ajoutent des
prolongements
variés (apophyses,
crochets...¦) des autres articles
du palpe (hanche,
fémur, patella,
tibia)(Schéma 6,
Fig.12 à 14).
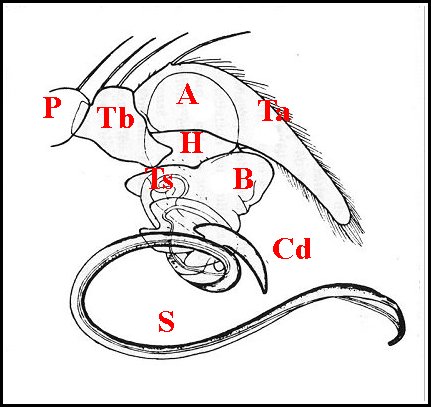 |
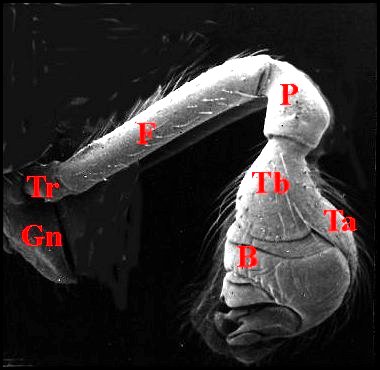 |
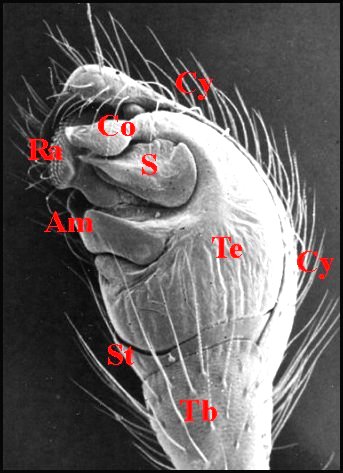 |
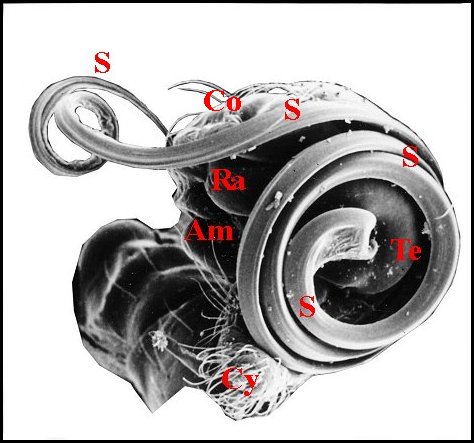 |
| Schéma
6 -
Aspect général d' un palpe
d'Araignée
entélégyne et son bulbe |
Fig.12
- Argyrodes cognatus
: palpe entier, avec bulbe. M.E.B. |
Fig.13 -Argyrodes cognatus : bulbe isolé,
autre vue. M.E.B. |
Fig.14-
Anelosimus
eximius : bulbe isolé. M.E.B. |
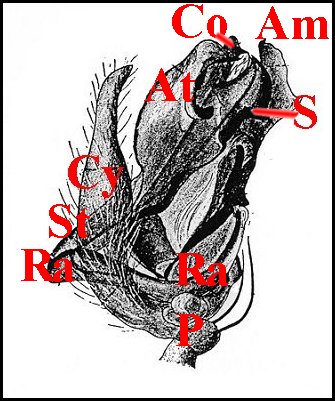
| A, alvéole - Am, apophyse médiane - B, bulbe et son style S - Co(Cd), conducteur - Cy (tarse, cymbium) - Gn, gnathocoxa - H, haematodocha - P, patella - Ra, radix -Ta, tarse - Tb, tibia - Te, tégulum - Sp, stipes - St, subtegulum - Ts, tube séminifère (vu par transparence). Fig.12 à 14 : © A.Lopez M.E.B. | |||
Leurs
formes et dispositions varient d'un groupe taxonomique à l'autre, y
compris entre
les
espèces d'un même genre ; elles
sont
ainsi d'une diversité
prodigieuse n'ayant d'égale que
celle de l'épigyne
femelle et, de ce fait, largement
utilisée en systématique. Au repos, les haematodochae
sont
collabées et les
pièces
chitineuses,
juxtaposées. Lors de l'accouplement ou
par artifice expérimental, les premières
deviennent
turgescentes sous la pression hémolymphatique,
dressant alors les sclérites
qui se
disjoignent et les
faisant saillir,
ainsi que l'embolus,
au-dessus
de la
surface de l'organe copulateur (Schémas
7 Ã 10).
 |
 |
 |
 |
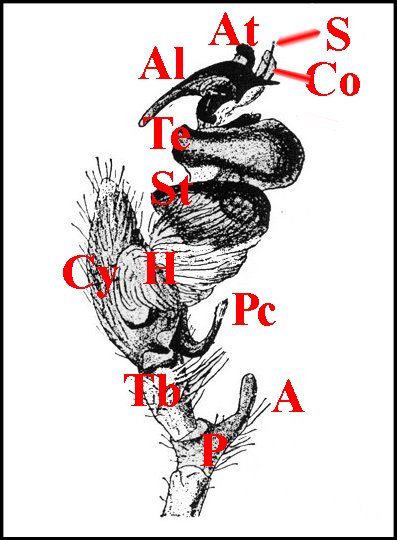
| Schéma
7 - Linyphia sp. : bulbe "au repos" |
Schéma 8 - Même bulbe en expansion | Schéma
9- Eriophora sp : bulbe
"au repos" |
Schéma
10
- Même bulbe en expansion |
| A, apophyse - Am, apophyse
médiane - At,
apophyse terminale - Co(Cd),
conducteur - Cy (tarse, cymbium) -
Gn, gnathocoxa - H, haematodocha - P,
patella - Pc, paracymbium - Ra, radix - S,
style - Ta,
tarse - Tb, tibia - Te, tégulum
- Sp,
stipes - St, subtegulum. |
|||
Le style
ou embolus a
une disposition très variable et se rattache,
d'après
Comstock (1912), à deux
grands
types. Dans le type conné, il n'est pas
séparé de la partie moyenne
du
bulbe et
se présente comme un simple prolongement rétréci
de ce dernier. Dans le type libre, une ou
plusieurs « articulations » mobiles le
séparent du
reste du bulbe et selon sa forme, il peut
se
rattacher à 3 sous-types : embolus
coniforme, lamelliforme, spiralé. Chez Telema tenella, araignée troglobie
pyrénéenne
exceptionnelle à maints égards, il
est conné, très court et revêt le
curieux aspect "primitif" d'une
apophyse unguiforme, close
à l'extrémité, prolongeant un bulbe
globuleux très
simple, déprimé en «cuillère» au
fond de
laquelle s'ouvre une
fente étroite donnant accés au
receptaculum (Lopez,1980d,).
Il peut être,
au
contraire, trés allongé (Scytodes,
Nephila)(fig.15), parfois
démesurément chez certaines
Araignées
Entélégynes (Fig.14),
au point de se présenter
alors comme un filament spiral
plusieurs fois plus long que le corps du
mâle (type
libre). De
plus, l'embolus
peut
se rompre durant la copulation et reste bloqué dans l'épigyne
femelle de certaines espèces d'Araneidae,
notamment celles qui ne
présentent pas
de dimorphisme sexuel salivaire (Lopez,1977b).
Ainsi «bouche»-t-il les voies
génitales et, en tant qu' obturateur embolique,
empêche que la femelle ne s'accouple à
nouveau
ultérieurement.
L'interêt
microscopique des pièces
chitineuses palpaires est à peu prés
nul si on le compare à leur importance morphologique
soulignée par les systématiciens. Faisant
donc
abstraction des haematodochae
et
des pièces
sclérifiées
enveloppantes, A.Lopez a seulement étudié le
contenu du bulbe
copulateur représenté
surtout par un tube
séminifère
que prolonge dans le style
son canal éjaculateur.
Le tube
est lui-même constitué par un
réservoir,
le receptaculum seminis,
avec son corps et son fond ou fundus
(Fig.15 Ã 18).
Chez les Pholcidae,
le réservoir
est court,
globuleux et ampullaire (Fig.19).
 |
 |
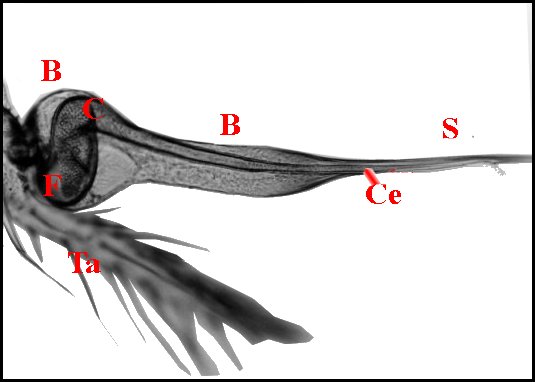
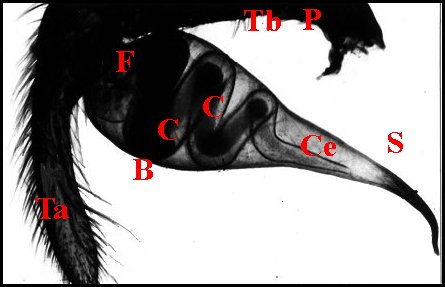 |
| Fig.15.- Scytodes thoracica : bulbe et tube séminifère | Fig.
16.- Détail de la précédente |
Fig.17.- Segestria florentina: bulbe et tube séminifère |
|
B, bulbe - C,
corps du receptaculum
- F,
son fundus - Ts, sa paroi - Ce, canal éjaculateur -
G, gamètes
(spermatozoïdes) - P,
patella - S, style - Ta, tarse - Tb, tibia. Le tube
séminifère et son contenu
gamétique sont vus par transparence dans ces
préparations éclaircies (© A.Lopez)
|
||
Lorsque l'auteur la décrivit pour la première fois en détails d'après plus de 100 espèces d'Araignées (Lopez,1977b ; Lopez,1977c), la structure microscopique du bulbe copulateur n'avait fait l'objet que d'un petit nombre de travaux basés sur une histologie très sommaire et limitée (Osterloh,1922 ; Harm,1931,1934 ; Cooke,1966 ; Lamoral, 1973) ( Note2) avec mention de «glandes annexes» débouchant dans la cavité du tube séminifère par des canaux trans-cuticulaires.
2. a - Canal éjaculateur
Sa longueur variable est proportionnée à celle de l' embolus, de ce fait particulièrement importante dans des genres tels que Nephila ou Scytodes donc le style est très développé (Fig.15). Sa lumière est étroite, généralement vide, entourée par une paroi externe chitineuse et par un épithélium interne simple, très adhérant, amphophile, non vacuolisé, dans l'ensemble peu lisible.
2. b - Tube séminifère
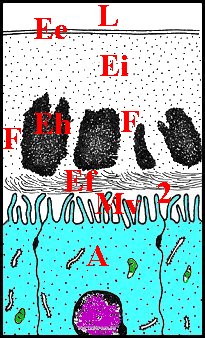
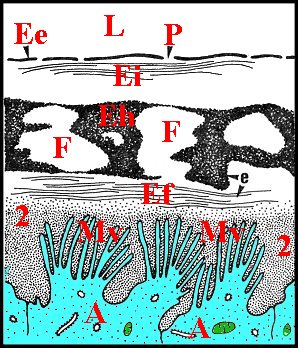
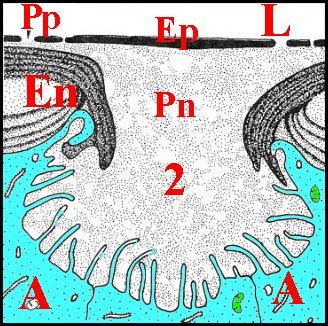
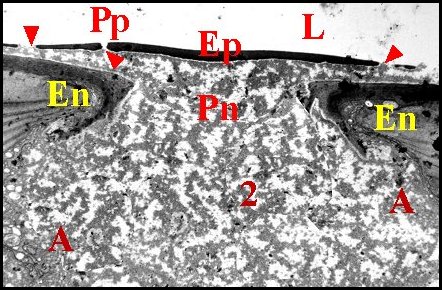
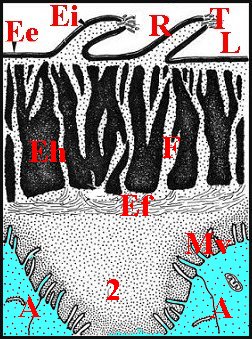
Comme son canal éjaculateur, il est formé par un épithélium et un conduit chitineux que sépare une cavité plus ou moins spacieuse. Cette dernière a reçu le nom de « chambre palpaire externe » (Lopez,1977b; Lopez,1977c) (Schéma 11).
2.b.1 - Epithélium
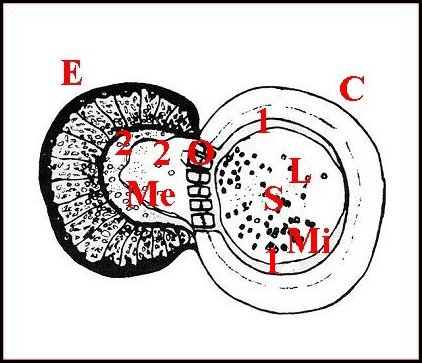
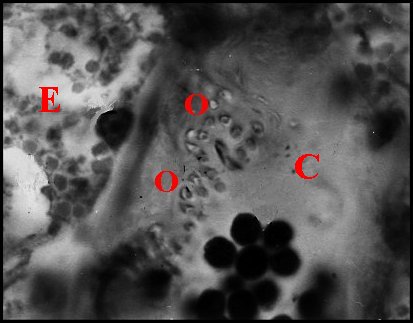
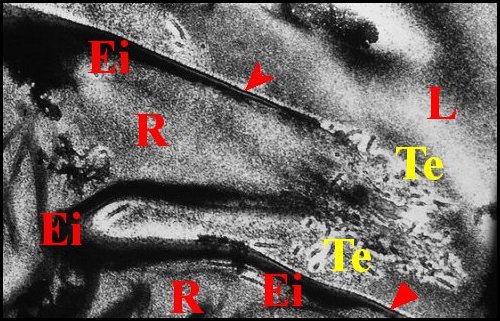
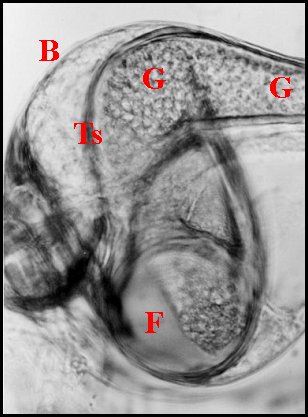
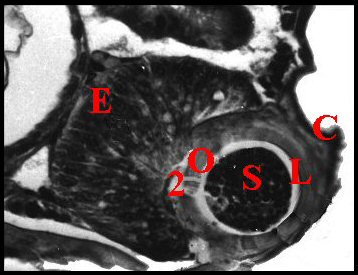 |
| Fig. 18.- Philodromus
praelustris Tube
séminifère
en
coupe histologique transversale |
| C, tube chitineux - E, épithélium - L, lumière - O, orifices - S, spermatozoïdes - 2, chambre palpaire externe (© A.Lopez C.H.) |
Le développement et la disposition de cet épithélium sécréteur sont extrêmement variables.
Dans le cas de Telema tenella, il a une étendue réduite et forme un «coussinet» bordant le réservoir sur une partie seulement de sa surface, «coussinet» que surmonte une "vésicule" où se love le spermatophore. Partout ailleurs, il présente un aspect indifférencié.
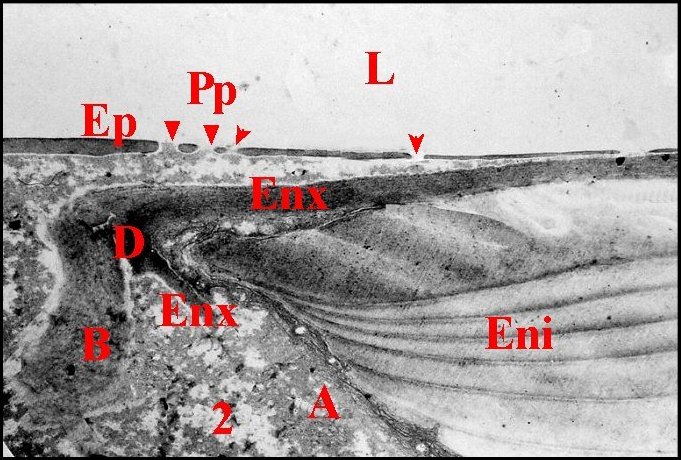
Chez la Mygale Nemesia caementaria, l' épithélium glandulaire est également limité à une zone pariétale incurvée, au niveau de la «cloison médio-bulbaire», le reste du réservoir étant revêtu par un épithélium banal (Lopez,1981d) (Schéma 12)
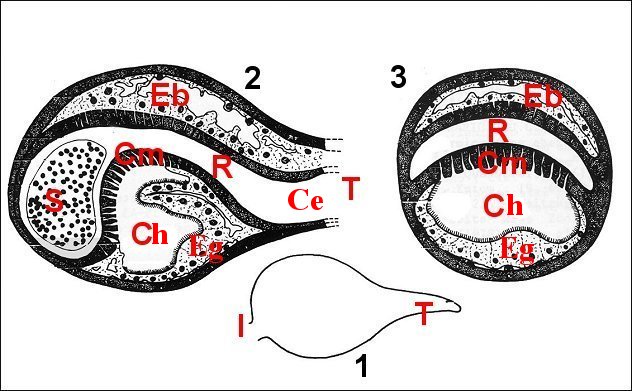 |
| Schéma
12 - Nemesia
caementaria : bulbe (1: contour) en coupes longitudinale (2) et
transversale (3) |
| Ce,canal
éjaculateur - Ch, chambre palpaire externe - Cm, cloison
médio-bulbaire - Eb, épithélium
banal - Eg, épithélium glandulaire - R, receptaculum
seminis - S,
spermatozoïdes (d'après Lopez & Juberthie-Jupeau, 1981) |
Chez Pholcus phalangioides et autres Pholcidae (Fig.19,20) l'épithélium glandulaire sous-jacent à la chitine du bulbe, borde un réservoir court se dilatant en ampoule et est séparé de sa cavité par le diaphragme anhiste (Lopez, 1974b)(fig.20).
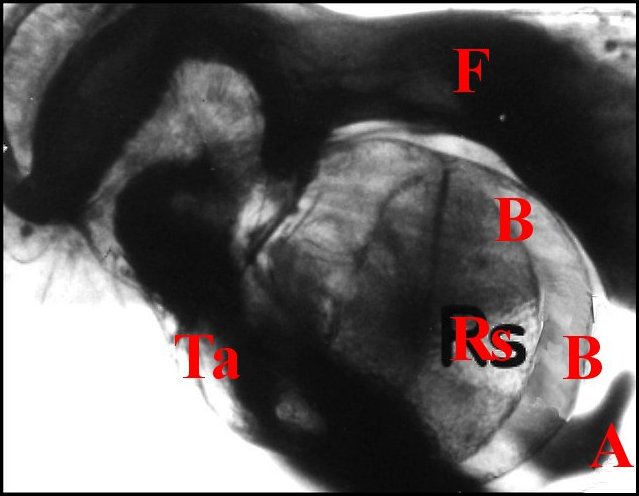 |
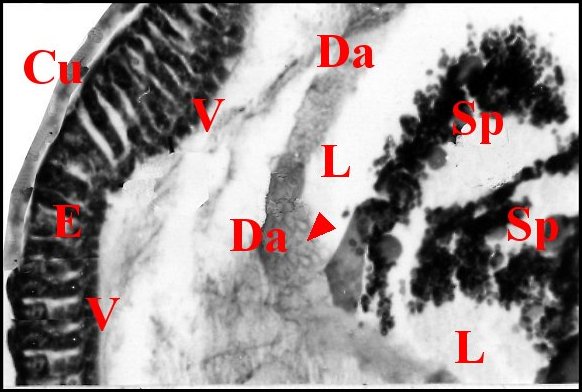 |
| Fig.19- Spermophora sp. : bulbe et tube séminifère | Fig.20- Pholcus phalangioides : coupe du bulbe. |
| A, apophyse
tarsale - B, paroi du bulbe - Cu, sa cuticule - Da, diaphragme anhyste
- E, épithélium - F, fémur - L,
lumière;
Rs, réservoir dilaté en ampoule, vu par
transparence -
Sp, spermatozoïdes -
Ta, tarse - V, microvilli. Préparation éclaircie (à gauche) et C.H. (à droite) (© A.Lopez) |
|
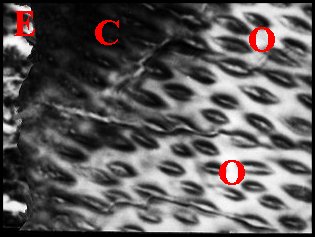
En revanche, chez Segestria et Dysdera, il parait discontinu et forme des culs-de-sac globuleux réguliers, séparés, en rapport étroit avec le conduit chitineux. (Fig.21).
|
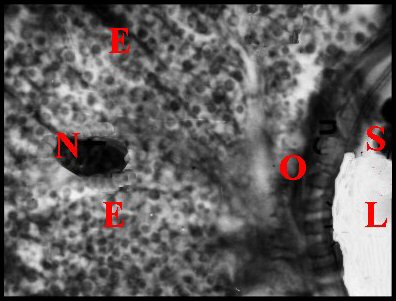
| Fig.21.-
Dysdera erythrina
: tube séminifère en coupe
histologique. |
| E, cul de sac épithélial avec ses "boules" de sécrétion - L, lumière - N, noyau de cellule épithéliale - O, orifices du tube chitineux - S, spermatozoïdes (© A.Lopez C.H.) |
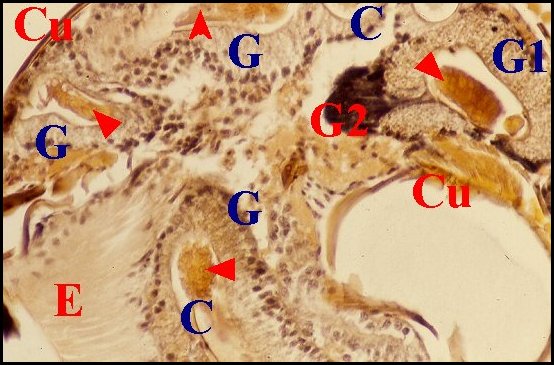
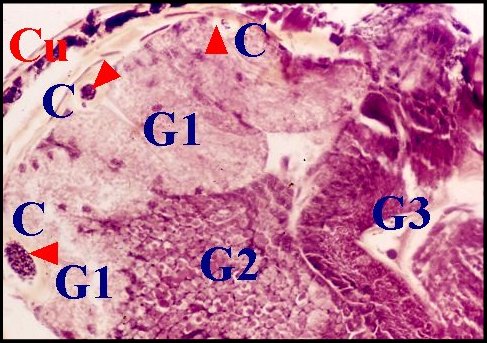
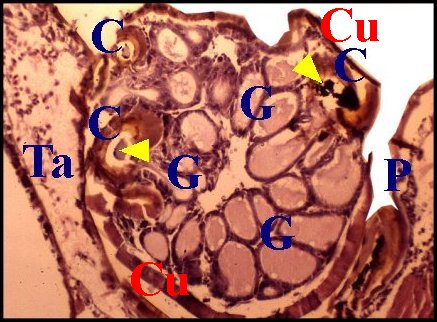
Chez de nombreuses autres Araignées, l'épithélium offre un développement si considérable qu'il occupe la majeure partie du bulbe. Il est festonné, "gaudronné" et constitue des diverticules plus ou moins profonds, étroits, sinueux ou globulaires, revêtant un aspect d'«acini», paraissant totalement isolés du tube chitineux et réalisant alors des images trompeuses de «glandes annexes» indépendantes (Wendilgarda, Argyrodes)(Fig.22, 23), pouvant atteindre un développement extraordinaire (Hersilia)(Fig.24). Néanmoins, les coupes histologiques en série montrent sans ambiguité que tous les espaces et l'épithélium adjacent font bel et bien partie d'un seul et même ensemble.
2.b.2 -Tube chitineux
2.b.3 - Cavités et membranes pariétales
Le conduit renferme des spermatozoïdes lorsque leur induction a été effectuée préalablement. Ils sont plus ou moins entourés par un matériel acidophile granuleux, retrouvé au M.E.T. sous forme de masses amorphes sphériques (Fig.41) pouvant correspondre à une sécrétion du déférent. De plus, le tube chitineux contient parfois une mince pellicule noir-bleuté distincte de sa paroi propre. Cette"membrane palpaire interne"(Lopez,1977b ; Lopez,1977c) est bien visible dans les coupes où elle s'est isolée de la chitine sous-jacente et y entoure la masse des gamètes (Schéma 11). En section transversale, elle apparait comme un conduit secondaire inscrit dans le tube sclérifié principal, en est séparée par un espace plus ou moins marqué, la «chambre palpaire interne» et se retrouve d'ailleurs en M.E.T. (confere infra). Il ne s'agit donc pas d'un artéfact du au décollement partiel de la chitine ou à une condensation marginale du «diluant» gamétique.
Dans le cas de Telema tenella, la composante cuticulaire du réservoir surmonte le coussinet épithélial et correspond à la "vésicule" logeant le spermatophore.
Chez la Mygale Nemesia caementaria, la zone de paroi chitineuse surmontant l'épithélium sécréteur prend l' aspect d'une « cloison médio-bulbaire » bombant dans le reste du réservoir (Lopez,1981d) (Schéma 12).
Chez Pholcus phalangioides, une fine membrane gaufrée, le diaphragme anhiste (Lopez,1974b) (Fig.20), sépare l' épithélium glandulaire de la cavité d' un réservoir en ampoule et se rattache sur son pourtour à la chitine bulbaire.
Un deuxième espace ou cavité, la «chambre palpaire externe», est située entre le tube chitineux et l'épithélium, s'interrompt là où le second se fixe sur le premier, a une étendue variable, est régulier et à peu près rectiligne dans les coupes longitudinales mais prend l'aspect d'un croissant en section transversale (Schéma 11).
Cette chambre palpaire externe ne peut être un artéfact technique de décollement. De plus, elle n'est pas traversée par des canaux excréteurs de cellules épithéliales sous-jacentes. En revanche, elle contient souvent une substance éosinophile, homogène ou grenue, provenant des «boules» observées dans ces mêmes cellules dont elle serait la sécrétion. De plus, elle renferme aussi une «membrane palpaire externe», structure originale non signalée avant les premières observations (Lopez,1977b; Lopez,1977c) et présente dans la plupart des familles examinées. Cette structure a comme la précédente un aspect de «voile flottant» ténu, légèrement acidophile et qui s'insère par les bords sur le canal sclérifié, en dedans de l'épithélium auquel il peut plus ou moins s'accoler (Schéma 11).
3 - Ultrastructure
Nous
avons utilisécomme
matériel d'étude les mâles de 9
espèces d'Aranéides appartenant à autant de
familles et
capturées par A.Lopez dans leur biotope : la Mygale Nemesia
caementaria
(Latr.)(Ctenizidae)
(Béziers,34,France) ; Telema tenella
Simon (Telemidae)
(grotte de Can Brixot, La
Preste, 66,France) ; Leptoneta
microphthalma Simon (Leptonetidae)
(grotte
de L'Espugne, Saleich,31,France) ; Zosis (Uloborus) geniculatus
(Olivier) (Mahé, Iles Seychelles) ; Segestria
florentina (Segestriidae)(Thézan
les Béziers,34,France) ; Pholcus
phalangioides
(Fuessl.) (Pholcidae)
(Cessenon,34,France) ; Araniella
cucurbitina (Clerck) (Araneidae)
(Mont
Caroux,34,France) ; Argyrodes
cognatus (Blackwall) (Theridiidae)
(Mahé, Iles Seychelles) ; Hersilia
savignyi
Lucas (Hersiliidae)
(Lunuwilla, Sri Lanka). Après fixation, parfois
sous les Tropiques, ils ont été tous
préparés et
examinés en M.E.T. au Laboratoire souterrain du
CNRS, Moulis 09200 (Note1).
Cette étude ultrastructurale confirme que le tube séminifère est bien formé par un réservoir ou receptaculum seminis et par un canal éjaculateur, comportant tous deux une partie cuticulaire et un épithélium. Ce dernier montre une différenciation glandulaire plus ou moins étendue au niveau du réservoir alorsqu'il est banal dans le deuxième conduit. De plus, une «chambre palpaire externe» (Lopez,1977a ; Lopez,1977b) est effectivement présente entre la cuticule et l' épithélium du réservoir dont elle reçoit la sécrétion.
3. a - Epithélium
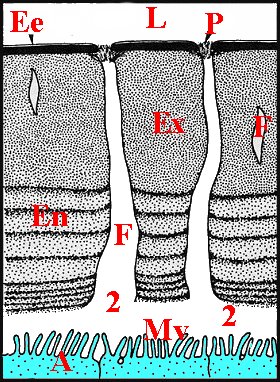
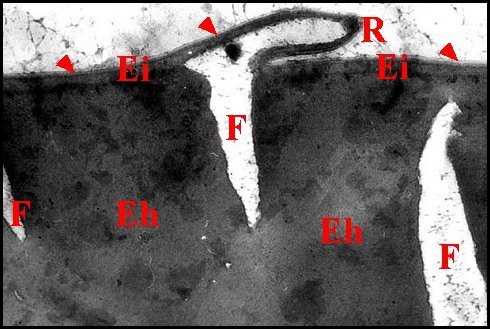
Il s'agit dans tous les cas d'un épithélium simple pouvant être considéré comme une invagination de l'épiderme dans le sinus hémolymphatique du tarse, un "bourgeon" pariétal étant à son origine et à celle de sa partie cuticulaire (Fig.27 ).
Cet épithélium
présente un
ensemble de caractères généraux retrouvés
chez les 9 espèces d' Araignées étudiées.
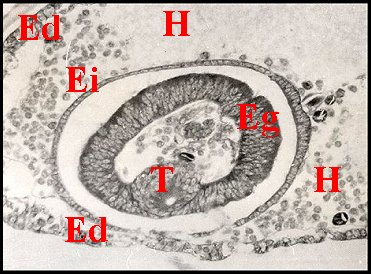 |
| Fig.27- Formation du tube séminifère |
| Ed, épiderme - Ei, son invagination - Eg, épithélium glandulaire et T, sa partie cuticulaire, provenant tous deux d'un "bourgeon" pariétal - sinus hémolymphatique (© A.Lopez C.H.) |
Les cellules
de l' épithélium
sont banales, à peu
prés
semblables à celles de l'épiderme,
non spécialisées et dépourvues
d'activité
glandulaire. Elles ont une taille réduite, peu
ou pas de
microvillosités
apicales, un cytoplasme
étroit
pauvre en mitochondries, du
réticulum
endoplasmique, et
un noyau plus ou
moins
irrégulier renfermant des
mottes périphériques de chromatine.
3.a.2 - Réservoir
Les cellules sont
de nature glandulaire,
donc des adénocytes,
prismatiques hautes et souvent très sinueuses. Elles
reposent
par leurs pôles
externes
sur
une fine lame basale les
séparant du sinus
hémolymphatique palpaire. Les pôles
internes ou apicaux
sont
orientés vers la cuticule
et
délimitent avec elle la chambre
palpaire externe, plus
ou moins spacieuse ; ils
ne
présentent pas d'invagination
de cet espace extracellulaire.
La membrane
plasmique des
mêmes
adénocytes montre des replis
augmentant considérablement sa surface : au
niveau
des
faces latérales, qui s'engrènent avec
celles des cellules
voisines, et surtout au niveau
du pôle basal (externe) où ce plasmalemme forme un
ensemble d' invaginations
(replis)
plus ou moins profondes, sinueuses
découpant le hyaloplasme
en compartiments
de taille variable,
enchevêtrés et dont l'aspect évoque des
pédicelles podocytaires
(Fig.28).
 |
| Fig.28.- Poles basaux d'adénocytes |
|
H, sinus
hémolymphatique -
Lb, lame basale - M, mitochondries - P, invaginations du
plasmalemme
(© A.Lopez M.E.T.) |
De plus, le
pôle apical est
hérissé de
microvillosités
plus ou moins longues et
nombreuses, et diversement réparties,
déja
entrevues en histologie. Elles
garnissent la
totalité des pôles
apicaux sauf
chez Hersilia
où ils comportent des zones sans microvilli
très étendues (Fig.34,35), et chez Pholcus où elles
se
réunissent en faisceaux ou en « éventails»
sur des apex d'aspect plus ou moins
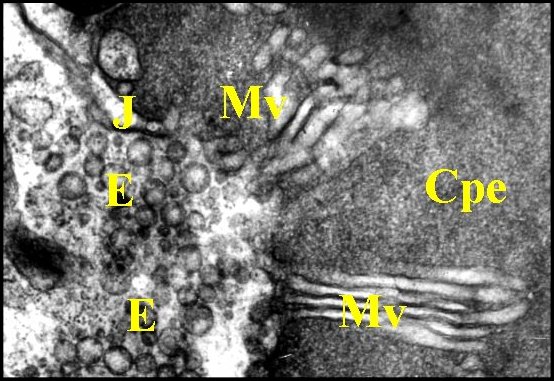
pédiculisé (Fig.29 Ã 31)
).
 |
 |
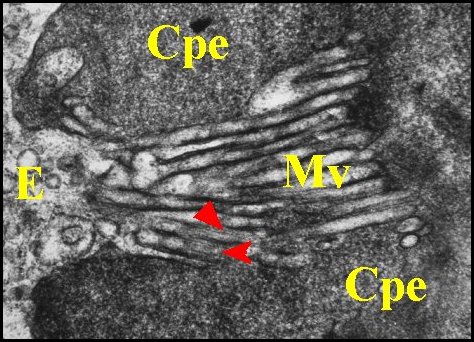 |
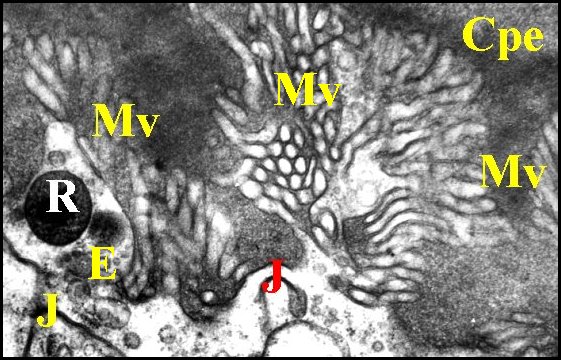
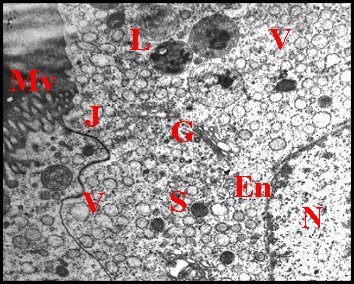
| Fig. 29 - Pholcus phalangioides : pôle apical | Fig. 30 - Pholcus phalangioides : pôles apicaux | Fig. 31 - Pholcus phalangioides : pôle apical |
| Cpe, chambre palpaire externe - E, vésicules d'endocytose (pinocytose) - J, jonction - Mv, faisceaux ou "éventails" de microvillosités - R, microorganisme parasite (Rickettsiale ?) . Flèches rouges : microfilaments dans les microvilli (© A.Lopez M.E.T.) | ||
Les microvillosités d' Argyrodes
sont trés nombreuses,
serrées, longues d'environ 1700 nm
(Schéma 19)
et
correspondent à la «bordure en brosse»
observée dans
les coupes histologiques (Lopez,1977a).
Celles de Nemesia sont également
nombreuses, régulières, légèrepment
flexueuses et atteignent une longueur de 3000 nm
(Lopez,1982)
(Fig.32).
Chez Leptoneta, elles sont encore
présentes en grand nombre mais décrivent des
sinuosités plus marquées (Lopez,1981)
(Fig.33) tandis que chez Telema,
elles sont moins abondantes et relativement
courtes (1200 nm) (Schéma
12).
Celles enfin de Segestria sont très
espacées,
diversement
orientées et atteignent 2000 nm (Fig.36). Dans tous
les
cas, les microvillosités contiennent des microfilaments,
peuvent
montrer une densification apicale
et sont parfois recouvertes (Leptoneta) d'un
matériel dense rappelant de la glycocalyx (Fig.
33).
 |
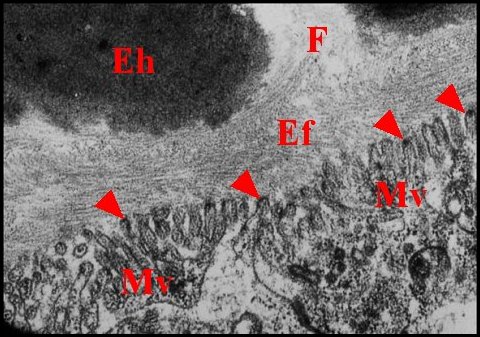 |
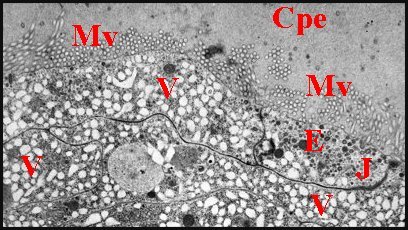
| Fig.
32 - Nemesia caementaria
: pôles apicaux
d'adénocytes |
Fig.33 - Leptoneta microphthalma : pôles apicaux d'adénocytes |
| Cpe, chambre palpaire externe - E, zone d'endocytose - Ef, épicuticule fibrillaire - Eh, épicuticule homogène - F, fenêtre - J, jonction sub-apicale - Mv, microvilli - V, vésicules de réticulum. Dans la Fig.33, les microvilli sont entourées de matériel dense et montrent parfois une densification apicale (flèches) (© A.Lopez M.E.T.) | |
Le noyau siège
généralement dans le tiers basal, est
arrondi,
ovoïde ou irrégulier, pourvu d'un
nucléole
sphérique, d'une
hétérochromatine
marginale peu abondante, d'un nucléoplasme
finement grenu et d'une enveloppe (Fig.34,35) en
nette
continuité avec le réticulum
endoplasmique
adjacent .
Ce
dernier est bien développé
et
confère à l'ensemble de la cellule
son aspect « spongieux » en microscopie
photonique. Il se
compose en périphérie de sacs
aplatis
(cisternae),
garnis de ribosomes
sur leur
face externe (réticulum
granulaire)et,
plus au
centre, de vésicules
dérivant manifestement de cet ergastoplasme.
Organites les plus
caractéristiques, elles sont
arrondies,
régulières , ne
portent pas
de ribosomes
sur la surface de leur
membrane (réticulum
lisse ou
dégranulisé) et
renferment un
matériel peu dense
aux électrons
(Fig.34,35).
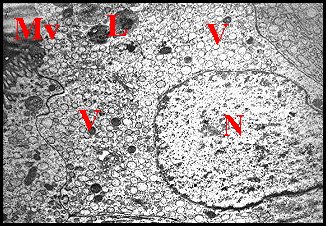 |
 |
| Fig.34 - Hersilia savignyi : adénocytes | Fig. 35- Hersilia savignyi : détail de la précédente. |
| En, enveloppe
nucléaire - G, dictyosome (appareil de Golgi) - J,
jonction - L,
lysosome - N, noyau - S, grain de sécrétion - V, vésicule du réticulum (© A.Lopez M.E.T.) |
|
L' appareil
de Golgi se compose de
dictyosomes
typiques formés par un empilement de quelques saccules
incurvés
(Fig.35). Chacun d'eux montre une
face externe ou de formation (versant
cis) à laquelle s'incorporent
des vésicules et
tubules
réticulaires (réseau
cis-golgien), des bords
et une face
interne
ou de maturation (versant
trans)
bourgeonnant un réseau
trans-golgien avec des tubules
et de
petites vésicules
rondes. Les dictyosomes
d' Hersilia
et Argyrodes
sont
petits, nombreux et
tendent à s'éparpiller dans le hyaloplasme.
En
revanche, ceux de
Telema tenella et Nemesia caementaria ont
une taille plus grande et tendent Ã
se réunir au voisinage du noyau,
y dessinant des images
annulaires
ou en
guirlande (Telema),
constituant même une véritable «aire
golgienne» d'aspect
spumeux avec les
innombrables vésicules qu'ils ont émises (Nemesia).
La sécrétion est
formée par
des grains développés à
partir du réticulum
et de l'appareil de
Golgi, régulièrement
arrondis (sauf chez Argyrodes), de taille très
variable, plus ou moins denses et résultant
parfois (Segestria) de la fusion de deux
types, l'un très osmiophile, l'autre
plus
clair (Fig.36). Ces grains
sont
extrudés dans la chambre
palpaire externe
entre les pieds des microvilli où se manifeste
aussi
une endocytose intense
traduisant à ce
niveau une capture très active de substances extracellulaires
par des vésicules
de
pinocytose
particulièrement nombreuses (Fig.32).
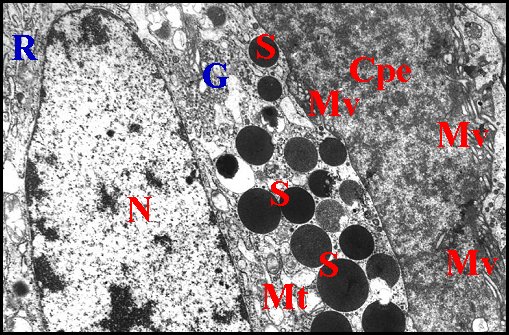 |
| Fig.
36 - Segestria
florentina : adénocyte et ses organites |
| Cpe,
chambre palpaire
externe - G, Golgi (dictyosome) - Mt, mitochondrie - Mv,
microvilli N, noyau - R, réticulum - S, grains
de
sécrétion (2 types) (© A.Lopez
M.E.T.) |
Des mitochondries
de taille et forme
variables
sont présentes dans tout le hyaloplasme, en particulier dans ses compartiments
basaux (Fig.28).
Les autres organites
sont des ribosomes
libres (polysomes), des
microfilaments et
quelques lysosomes (Fig.20,21).
La
cohésion épithéliale est
assurée
par l'engrènement latéral
des adénocytes (interdigitations) et par des jonctions, surtout des
zonula adherens sub-apicales
(Fig.29,30,32)
auxquelles font suite des
jonctions
septées de longueur variable.
3.b - Partie cuticulaire
3.b.1 -Cuticule extraglandulaire
La cuticule du canal éjaculateur et de la partie de tube séminifère sans épithélium différencié présente une ultrastructure complexe, semblable à celle du tégument, si l'on excepte toutefois Telema tenella où elle se réduit à de l'épicuticule .
3.b.2 -Cuticule surmontant l'épithélium glandulaire
La
cuticule
surmontant l'épithélium
glandulaire
montre
en revanche d'importantes variations portant sur son
épaisseur,
sa continuité et la nature de ses couches.
►Telema
tenella (Figs.
37,38 et
Schéma 18) possède
une cuticule
extrêmement
mince (0,1
µm) correspondant à la
"vésicule" des
coupes histologiques. Très
simple,
elle se réduit à la seule épicuticule, fin
liséré
sinueux qui court, en ondulant, au voisinage des apex adénocytaires et est formée par les
deux sous-couches habituelles, externe et interne (Fig.37,38). Cette épicuticule
est continue au
niveau de l'épithélium
indifférencié,
présente comme lui des
replis marqués lorsque la cavité
réceptaculaire ne loge pas un spermatophore mais
est en revanche
discontinue au dessus des adénocytes
dont la
sépare une chambre
palpaire
externe étroite. L'
épicuticule est interrompue
à ce niveau par des pores nombreux, réguliers,
arrondis, larges de 100 à 150 nm et
espacés de 150
à 800 nm. Au pourtour de chacun d'eux, l' épicuticule externe, très
osmiophile, s'invagine en un petit bourrelet saillant dans la chambre palpaire sous-jacente
(Fig.37,38,schéma
13). Cette
dernière renferme une substance granuleuse occupant
aussi
la
cavitédu
receptaculum.
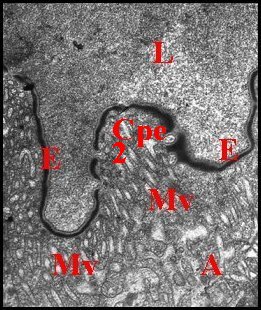 |
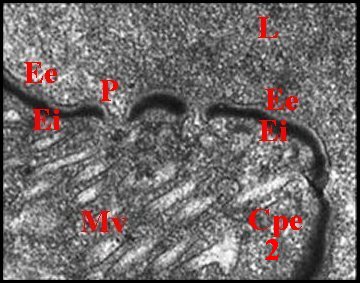 |
 |
|
Fig.37-
Telema tenella :
lumière et paroi du receptaculum
|
Fig.38 - Telema tenella
: paroi du receptaculum, détail |
Schéma 13 - Telema
tenella : paroi du receptaculum |
| A,
adénocytes - Cpe (2), chambre palpaire externe - E,
épicuticule - Ee, é.externe - Ei, é.interne - L,
lumière - Mv, microvilli -
P, pore (© A.Lopez M.E.T.) |
||
►
Leptoneta
microphthalma
(Fig.39,40 ;
Schéma 13)
se
singularise d'abord par une épicuticule qui est
dépourvue de pores, donc
ininterrompue (Lopez,1981 ; Lopez,1985). l'
épicuticule
externe correspond
au liséré péricavitaire des
coupes histologiques,
a une épaisseur uniforme (environ
400 °A) et parait se composer de 3 feuillets :
deux sombres en encadrant un plus clair. L'épicuticule
interne a
par
contre une épaisseur variable pouvant atteindre 5 µm dans
le réservoir. Elle
est constituée d'un matériel peu
dense aux électrons, le plus souvent granuleux, parfois
fibrillaire
et se confondant avec la «chambre
palpaire interne»
en microscopie photonique.
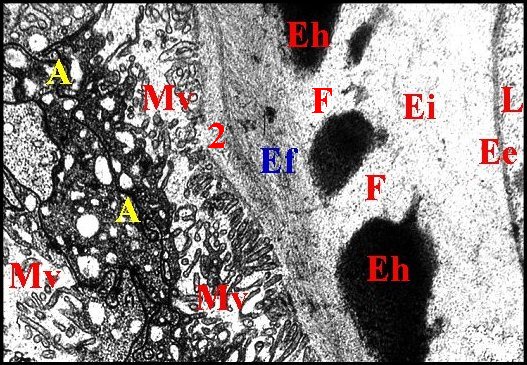 |
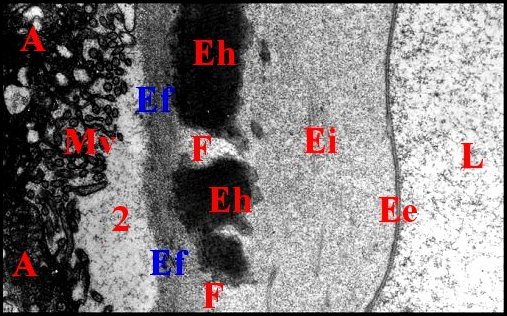 |
| Fig.39 - Leptoneta microphthalma : lumière et parois réceptaculaires | Fig.40 - Leptoneta microphthalma : lumière et parois réceptaculaires, autre coupe |
| A,
adénocytes - Ee, épicuticule externe -
Ef,
endocuticule fibrillaire - Ei, épicuticule interne -Eh,
endocuticule homogène fenestrée - F,
fenêtre - L,
lumière - Mv, microvilli - 2,
chambre
palpaire externe (© A.Lopez
M.E.T.)
|
|
L'endocuticule
se distingue de
toutes les
autres espèces par sa structure originale.
Dense,
homogène
et d' épaisseur
constante (0,5 µm) dans le canal éjaculateur,
elle montre en revanche deux couches très
différentes dans
la
plus grande partie du réservoir
(Fig.39,40
;
schéma 13).
La plus externe est
très
contrastée, homogène, mais
discontinue et
d'aspect «fenestré» ;
elle se
compose d'anneaux espacés, plus
ou moins anastomosés, qui
encerclent le réservoir
et
entre lesquels s'insinue un matériel peu dense
semblable à celui de l' épicuticule
interne.
La plus interne
se situe entre la
précédente et l'épithélium
sous-jacent ; elle se
compose de deux
strates moyennement
denses aux électrons, d' épaisseur
assez constante, fibrillaires et montrant aussi la
structure en arceaux
propre à l' endocuticule
(Fig.39,40 ; schéma
13)
►
Pholcus
phalangioides
(Schéma
14) présente une partie
cuticulaire repérée en
histologie sous le nom de « diaphragme
anhiste »
mais apparue discontinue lors de l' examen ultrastructural
sommaire
associé (Lopez,1974b).
Epaisse d'environ
5 µm, elle se compose d' une épicuticule
externe
percée de pores, d'un espace étroit
occupé par des fibrilles
correspondant peut être à l'épicuticule
interne dissociée et d'endocuticule. Cette
dernière est
elle-même formée par deux couches rappelant
celles
de Leptoneta
: une externe homogène
mais largement
fenestrée et une interne fibrillaire. Les fenestrations
sont sinueuses,
irrégulières et semblent
interrompre toute
l'épaisseur de l'endocuticule
en des zones
limitées
(Lopez,1985).
 |
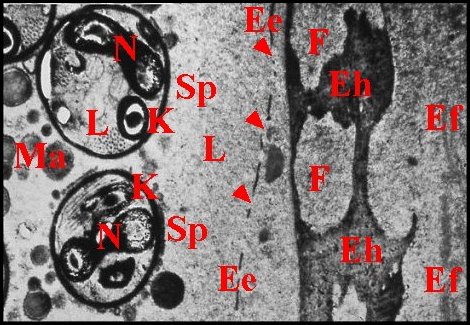 |
| Fig. 41 - Pholcus phalangioides : cuticule, lumière et gamètes | Fig. 42 - Pholcus phalangioides : cuticule et gamètes, détail. |
| Ee, épicuticule externe - Ef, endocuticule fibrillaire - Ei, épicuticule interne - Eh, endocuticule homogène - F, ses fenêtres - L, lumière - Ma, matériel amorphe - S,Sp, spermatozoïdes avec leur coque d'enkystement (K), leur noyau (N) et leur flagelle . Flèches : pores de l'épicuticule externe (© A.Lopez M.E.T.) | |
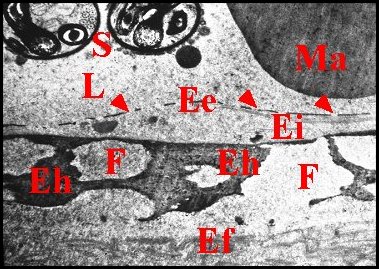
► Chez Segestria
florentina (Schéma
15
; Fig.43,44) l'épicuticule
est plus ou moins épaisse et ajourée également par
de petits pores à
répartition
discontinue. l'endocuticule
sous-jacente est très
développée (près
de 8 µm) et formée par deux couches
bien
distinctes : l'endocuticule
externe,
superficielle, monostrate, densément fibrillaire ; l'endocuticule
interne, profonde, plus épaisse, stratifiée et
assez claire. Ces deux
couches
sont interrompues par de grands
pores
(diamètre :
5 Ã 6 µm)
beaucoup plus larges que ceux de l'épicuticule
et
montrant une
structure
complexe originale.
Sur
le pourtour de chaque
orifice, l'endocuticule
externe s'invagine
en un bourrelet circulaire
infundibuliforme
paraissant «serti» dans l'endocuticule
interne et
comme dédoublé
en «bobèche» (Schéma
15 ; Fig.43,44). De plus, l' épicuticule recouvre l'ouverture
de
chaque grand pore à la
manière d'un
diaphragme épaissi en son centre et, dans sa
périphérie,
percé de nombreux petits
pores.
Elle
pourrait correspondre au «tube interne de chitine
bleue»
(Harm, 1931) et à
la "membrane palpaire
interne"
(Lopez,1977a ;
Lopez,1977b).
►
Chez Nemesia
caementaria ( Schéma
16 ; Fig.45,46),
la
partie centrale de la cloison
médio-bulbaire surmontant les microvilli (Schéma
12) présente
une cuticule épaisse
(environ 20 µm) ajourée par des canaux
poraires ou pores canaux. Ils sont
nombreux, souvent
larges à leur base de plus de 1 µm,
irréguliers,
plus ou moins flexueux et souvent ramifiés (Lopez,1982).
Ces canaux traversent trois des
couches cuticulaires :l'endocuticule
reconnaissable à sa
stratification, l'exocuticule,
plus
homogène (Fig.46) et
enfin, une épicuticule
qui présente des pores.
Chaque canal émet
à son
extrémité apicale un réseau
divergeant de
canalicules, les tubules épicuticulaires (Fig.45).
Les uns
s'insinuent
entre la cuticule chitineuse
et l'épicuticule ;
les autres traversent
cette dernière au niveau des pores
pour s'ouvrir dans la
cavité du receptaculum, établissant
ainsi une
liaison directe, bienqu' étroite, entre cette
lumière et
la chambre palpaire externe.
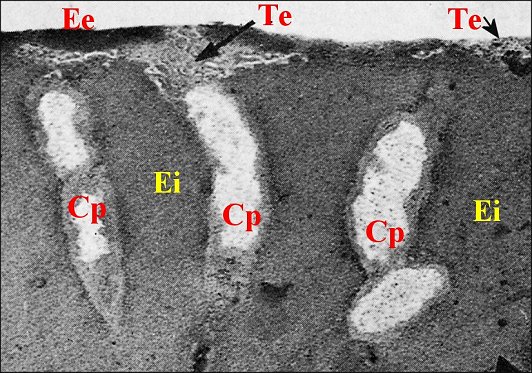 |
 |
| Fig.45- Nemesia
caementaria : cloison
médio-bulbaire, partie haute |
Fig.46-
Nemesia
caementaria : cloison
médio-bulbaire, partie basse (rotation de 90°)
|
|
Ee,
épicuticule externe - Ei, épicuticule interne
- Ex, épicuticule externe - En, endocuticule - Cp, canal poraire
- Te
(et flèches), tubules épicuticulaires.
Flèche
(Fig.46) : vers l'ouverture d'un canal dans la chambre palpaire externe
(©
A.Lopez M.E.T.)
|
|
► Chez Hersilia
savignyi (Schéma.17; Fig.47
à 49), la
paroi réceptaculaire
(épaisseur : 7,5 µm)
montre une épicuticule à
disposition
très particulière, une couche d'endocuticule
externe
et une endocuticule interne fenestrée.
L'
épicuticule
n'est pas
uniformément
parallèle à l'endocuticule
sous-jacente mais se
soulève en replis
faisant saillie
dans la cavitè
réceptaculaire. Ces
replis, plus ou moins arqués, ont l'aspect
de
digitations courbes
lorsque le receptaculum
a été coupé en long, sont
tous inclinés dans
le même sens, et présentent, au niveau
de leur apex,
un pore occupé
par des tubules
épicuticulaires
en «bouquet»
(Fig.47,48,49).
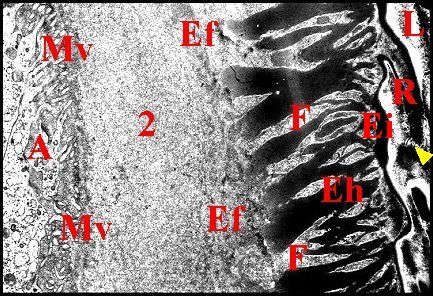 |
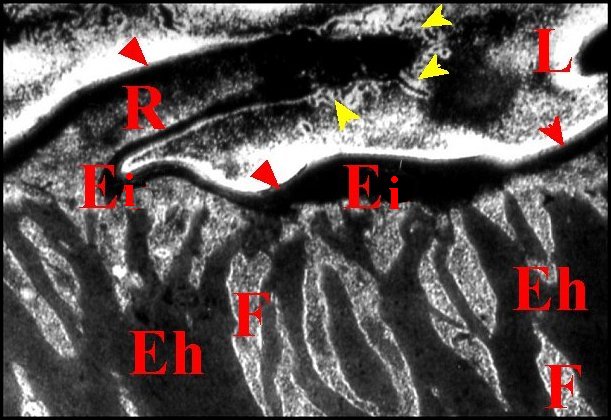 |
| Fig. 47 -Hersilia
savignyi : Cuticule et chambre
palpaire externe. |
Fig.48
- Hersilia
savignyi : Détail de la cuticule
(rotation 90°) |
| A, pôle
apical d'adénocyte - Ee, épicuticule
externe
- Ef, endocuticule externe fibrillaire - Eh, endocuticule interne
fenestrée - Ei, épicuticule interne -
F,
fenestration endocuticulaire -L, lumiére - Mv, microvilli
des
adénocytes - R, repli épicuticulaire -
2, chambre
palpaire externe. Flèches jaunes :
tubules épicuticulaires en "bouquet" -Flèches
rouges :
liséré d'épicuticule externe. (© A.Lopez M.E.T.) |
|
►
Chez
les trois
dernières
espèces (Araniella
cucurbitina, Argyrodes cognatus, Zosis
geniculatus)
(Fig.50
à 54 ; Schémas
18,19), la paroi
réceptaculaire,
épaisse respectivement de 4 µm, 10 µm et près
de 4 µm) montre encore de l'épicuticule
se soulevant comme chez Hersilia
en replis intra-cavitaires, une
couche d'endocuticule externe
fibrillaire, plus nette toutefois que précédemment,
et une couche d'endocuticule
interne.
 |
 |
| Fig.50 - Araniella cucurbitina : cuticule, adénocytes | Fig. 51 - Araniella cucurbitina : cuticule, adénocytes. Détail |
| A, adénocytes - Ef, endocuticule fibrillaire -Eh, endocuticule homogène - Ei, épicuticule interne - F, fenêtre - L, lumière - Mv, microvillosités - R, repli épicuticulaire. Flèches : épicuticule externe (© A.Lopez M.E.T.) | |
Les replis de l' épicuticule ont l'aspect
de
courtes «digitations» ou de «pendeloques»
lorsque le tube
séminifère est
coupé
longitudinalement. Contrairement à ceux d' Hersilia
(Schéma 17) et à l'épicuticule
plane de Nemesia
(Schéma 16),
ils
ne présentent aucune solution de continuité de
sorte que
l' épicuticule parait
bien
ininterrompue d'un bout à l'autre du
receptaculum.
L'endocuticule interne est
toujours épaisse,
homogène, mais interrompue comme chez Nemesia
et Hersilia par
des fenestrations. Ces
dernières sont étroites, allongées, grossièrement
parallèles les unes aux autres, de section elliptique dans
les
coupes tangentielles ou très obliques et ainsi
responsables
des images en « boutonnières» de la
microscopie
optique (Fig.26). Une seule
d'entre elles (Schémas 18,19) et non plusieurs
comme chez Hersilia (Schéma
17),
correspond à chaque repli ou
digitation épicuticulaire.
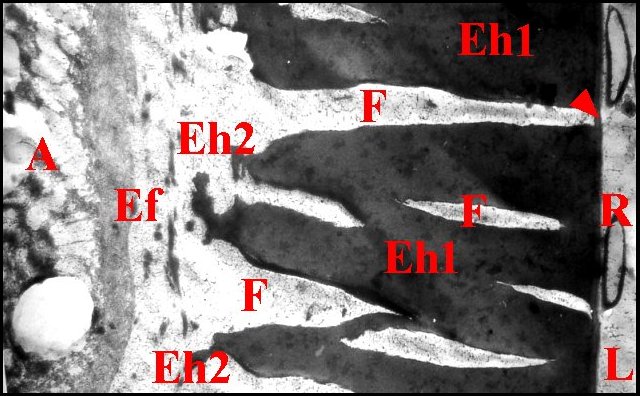
Dans le cas d'Argyrodes, la partie
profonde ou basale
de l'endocuticule
interne semble se fragmenter
en une série de petits blocs anguleux et plus ou moins
"effilochés" au contact de l'endocuticule
fibrillaire (Schéma
19, Fig. 54).
 |
 |
 |
| Fig.52.
- Argyrodes cognatus :
cuticule, adénocytes |
Fig.53
- Argyrodes cognatus :
cuticule
(rotation 90°) |
Fig.54 - Argyrodes cognatus : endocuticules
|
|
A,
adénocytes - Ef, endocuticule
fibrillaire - Eh, endocuticule
homogène avec ses parties superficielle (Eh1) et
basale
fragmentée (Eh2) -
Ei, épicuticule interne -
F, fenêtre ; L, lumière - Mv,
microvillosités -R,
replis épicuticulaires. Flèches : épicuticule
externe. 2 : chambre
palpaire externe (non
visible dans Fig.52,53) (© A.Lopez
M.E.T.)
|
||
3.c -Rapports
de
l'épithélium et de la partie
cuticulaire
Ils diffèrent
selon que l'épithélium
est continu, avec ou sans culs
de sac,
ou réellement
discontinu.
3.c.1 -
L' épithélium est
continu chez Nemesia
(Mygalomorphe),
Telema,
Leptoneta,
Pholcus,
Araniella, Zosis)(Araneomorphes)
et n'adhère à la cuticule (tube
chitineux) qu'en bordure de
la zone ajourée par des orifices, fenestrée
ou, tout au
moins,
différenciée (Leptoneta). Il se
présente comme
une membrane plus ou moins plissée comprise
entre le
sinus hémolymphatique
et la chambre palpaire externe,
cette cavité étant continue, non
compartimentée. Il n'existe
aucun rapport entre le nombre des replis
épithéliaux, probablement transitoires, et
celui des pores ou fenestrations qui doit être
constant.
3.c.2 – L'épithélium
est également continu
mais forme des
culs de sac permanents (Argyrodes,
Hersilia), plus ou
moins profonds, étroits et sinueux ou globulaires. Ils
ont
ainsi l'aspect d'«acini»
signalé dans les coupes
histologiques, au point d'y paraître totalement
indépendants de la partie cuticulaire (Fig.23,24) (Lopez,1977b).
Dans le cas d'Argyrodes, chaque cul de sac épithélial
semble entrainer avec lui de l'endocuticule
fibrillaire et des "fragments"d'endocuticule
fenestrée
(partie basale) (Schéma 19,
Fig.54). De plus, il
est en rapport avec une seule fenestration
endocuticulaire et le repli
d'épicuticule correspondant
(Schéma 19; Fig.52,53).
Chez Hersilia,
l'endocuticule
n'accompagne pas les culs de sac (Schéma
17).
Ils ont l'aspect de
poches
globuleuses juxtaposées et plus ou moins
"pédiculisées"
car
leur épithélium est
extrêmement lâche. Chacun d'eux est en rapport
avec plusieurs
fenêtres endocuticulaires.
3.c.3
–l'épithélium est
réellement
discontinu (Segestria). Il forme encore des culs de sac, d'aspect globuleux
mais cette fois bien
individualisés et isolés les
uns des
autres. Chacun d'eux entre en rapport
très étroit avec la cuticule car
il s'insère isolément au pourtour
d'un grand pore
(Schéma 15,
Fig.43), son groupe
de cellules
épithéliales prenant attache à ce
niveau sur l'endocuticule
et son bourrelet échancré
et
correspondant, vraisemblablement, à une
«rosette» de Harm (1931).
Il
résulte de ces différentes descriptions que l'
épithélium sécréteur du tube
séminifère
est isolé de la composante
cuticulaire par
une cavité d'importance variable, la chambre
palpaire externe (Fig.29, 32,43,47). Elle renferme
presque toujours un matériel
finement granuleux,
peu dense aux électrons, de
nature sécrétoire
et
qu'ont élaboré les adénocytes
sous-jacents. Ce
matériel se retrouve dans les fenestrations
endocuticulaires (Nemesia,
Hersilia, Araniella,
Argyrodes, Zosis) et au delà , dans les replis épicuticulaires
des
4 dernièrs
espèces. Lorsque qu'ils sont ininterrompus(Araniella,
Argyrodes,
Zosis)
(Schémas 18,19;
Fig.53),
le matériel sécrétoire ne peut
passer dans la
lumière du receptaculum
ou inversement en
provenir car il n'existe aucune voie de communication avec elle. En
revanche, les
discontinuités de l'épicuticule
dans le cas d' Hersilia
(Schéma 17 ; Fig.49)
permettent à
l'ensemble
des cavités pariétales
d'être en
rapport très
limité mais bien réel avec la lumière.
4.a -
Au
point de vue anatomique, l'étude ultrastructurale montre
que
la paroi du réservoir séminifère (receptaculum
seminis)
► est
dépourvue de cellules
sécrétantes à canaux
individuels (
classe 3 selon Noirot
et
Quennedey, 1974).
► comporte
bien un épithélium glandulaire uniquement
constitué par
des adénocytes
de classe 1
(toujours selon
Noirot et
Quennedey, 1974), riches
en
réticulum,
appareil de
Golgi, grains
de
sécrétion et pouvant former des
culs-de-sac plus ou moins
globuleux simulant,
en histologie sommaire, des glandes
acinoïdes séparées (Harm,1931,1934 ;
Lamoral, 1973).
► que
cet épithélium est également
absorbant
( microvillosités
apicales,
endocytose intense,
replis
basaux du
plasmalemme).
►
qu'il
existe bien une « chambre
palpaire externe»
(Lopez,1977a
; Lopez,1977b) correspondant
à un
espace extracellulaire particulièrement vaste
situé
entre le même épithélium
et la paroi cuticulaire sus-jacente, renfermant
un matériel
sécrétoire
que les adénocytes élaborent mais
aussi réabsorbent.
* une
endocuticule à couche
externe de texture fibrillaire
lâche,
correspondant vraisemblablement à la «membrane
palpaire externe», et à couche interne
fenestrée par des canaux
poraires.
* une
épicuticule qui est soit ininterrompue mais peut
alors former
des
replis ou délimiter une «chambre
palpaire
interne" (Lopez,1977a ; Lopez,1977b) en
regard des fenestrations
endocuticulaires, soit interrompue par des pores
libres ou qu'occupent
des canaux (tubules) épicuticulaires.
4.b - Au point de vue fonctionnel,
le
tube séminifère du bulbe a une
activité
sécrétrice par son épithélium glandulaire. Ce
dernier soustrait du liquide au sinus
hémolymphatique sous-jacent par ses replis
adénocytaires
basaux riches en mitochondries et élabore des
glycoprotéines
(réticulum, Golgi). Il produit ainsi les grains d'une
sécrétion qui est
libérée dans la chambre
palpaire externe et
l'emplit
sous forme d'un
matériel fluide peu dense aux électrons.
Mais
cet épithélium est également susceptible de
résorber la même
sécrétion au niveau des pôles apicaux
de ses
adénocytes car
ils sont riches
en microvilli et
montrent une endocytose trés active.
Elle passerait ains dans le hyaloplasme,
gagnerait les cavités du réticulum
et, de là , le sinus
hémolymphatique sous-jacent.
La sécrétion permet à l' Araignée mâle d'effectuer son induction spermatique en étant réabsorbée dans un premier temps, et l'éjaculation secondaire, en étant réémise dans une seconde étape, qu"elle se confine à la paroi du réceptaculum lorsque son épicuticule n'est pas perforée (Leptoneta, Zosis, Araniella, Argyrodes), ou qu'elle puisse pénétrer dans sa cavité (du moins dans celle de la chambre palpaire interne) par des orifices pariétaux très variés (Nemesia, Telema, Pholcus, Segestria, Hersilia). La sécrétion épithéliale se présente en effet comme un «liquide moteur» assurant les déplacements du sperme, sa circulation étant «libre», lorsque l'épicuticule est perforée, ou limitée à la paroi réceptaculaire lorsqu'elle est ininterrompue. Chez Leptoneta, il se produirait toutefois une imbibition de l'épicuticule interne à structure très lâche plutôt qu'un flux liquidien dans des cavités préformées.
Le sperme a été préalablement déposé sur la toile spermatique par «masturbation» et éjaculation primaire, sous contrôle des sensilles gonoporales et après adjonction éventuelle du produit des glandes épigastriques prégonoporales. Il est alors recueilli par le mâle d' Araignée avec ses bulbes palpaires.
Cet acte a reçu diverses appellations anglo-saxonnes : «Sperma-Aufnahme» ou «Tasterfullung" en langue allemande ; "Sperm induction», introduit par Montgomery (1903) en langue anglaise et trés utilisé depuis. Jugeant le dernier terme plus explicite que "remplissage des tubes séminiféres» (Millot, 1949), l'auteur l'a volontiers adopté en le francisant car il ne dissone pas (Lopez,1977a ; Lopez,1977b). L'induction spermatique a été observée pour la première fois par Menge (1843) et depuis, maintes fois décrite chez de nombreuses espèces d'Araignées par U.Gerhardt et autres zoologistes. Il s'agit d'une manoeuvre imprévisible et d'observation délicate, facilitée toutefois dans les familles où se produisent des accouplements itératifs (Linyphiidae): ainsi, l' induction est bien repérable chez les Erigoninae et surtout les Linyphiinae car elle y survient entre deux copulations successives.
L'acte perceptible est une immersion simultanée ou alternative des emboli dans la masse spermatique, soit à travers les mailles de la toile speciale de même qualificatif, peut-être aussi la sécrétion épigastrique ( induction indirecte : «Indirekte Sperma-Aufnahme» de Gerhardt) (Fig. 55), soit sans traverser le tissu soyeux et sa doublure (induction directe : « Direkte Sperma-Aufnahme» de Gerhardt) .
 |
| Fig.55- Induction indirecte (Dinopide), Ã travers la toile spermatique (T) . P, palpes et bulbes. (d'après Clyne) |
Il est
admis classiquement que l'
induction
spermatique est soit un simple
phénomène
de « capillarité»
adopté
sans restriction (Millot,
1968 ; Lamoral, 1973; Foelix
1982), soit liée à une
réabsorption
de
sécrétats, les zoologistes qui envisagent
cette
deuxième hypothèse (Harm,
1931 ; Cooke, 1966) la
jugeant d'ailleurs peu satisfaisante.
L'étude
ultrastructurale au M.E.T (Lopez,1985)
montre que l'induction,
tout
comme l' éjaculation secondaire
qui
lui fera suite,
est
sous la dépendance d'un
mécanisme beaucoup plus
subtil,
déja entrevu lors
de l'examen histologique (Lopez,1977a
; Lopez,1977b),
déniant au tube
séminifère le
rôle d'une simple «pipette» et associant, dans les
deux cas l'activité cytologique de l'épithélium
et la mobilisation originale d'un
systême «membranaire».
Il s'agit d'un mécanisme actif reposant
sur une mobilisation
liquidienne et mettant en
jeu, d'une part les adénocytes
épithéliaux,
d'autre
part la paroi cuticulaire
et
surtout son épicuticule qui doit jouer un rôle
important
dans le
fonctionnement du réservoir.
Lors de l'induction, le liquide
serait résorbé massivement
au
niveau des pôles
apicaux
adénocytaires. Il
se produirait ainsi
une chute brutale de la
pression
intra-cavitaire, cette dépression
active
expliquant
beaucoup mieux l'ascension du sperme dans le bulbe et son
tube séminifère
que d' hypothétiques
«forces
capillaires»
encore invoquées de nos jours (2023)
par divers auteurs. L'ensemble des gamètes
se comporterait quelque peu comme une sorte de ludion !.
4.b.2-L'éjaculation
secondaire, à différencier de la primaire , conséquence d'une "masturbation" sur la toile
spermatique est
l'émission du liquide séminal dans les voies
génitales femelles
lors
de l'accouplement
effectué dans des
positions
très diverses (Fig.56 Ã 59). Cette copulation est
réalisée
en insérant
un seul style
ou les
deux, soit simultanément,
soit en alternance.
 |
 |
 |
| Fig.56 - Pholcus
phalangioides : Accouplement |
Fig.57 - Leucauge
argyra : Accouplement |
Fig.58 - Tetragnatha
extensa
: Accouplement |
| F, femelle -
M, mâle - P, palpe (s) Photos
A.L. |
||
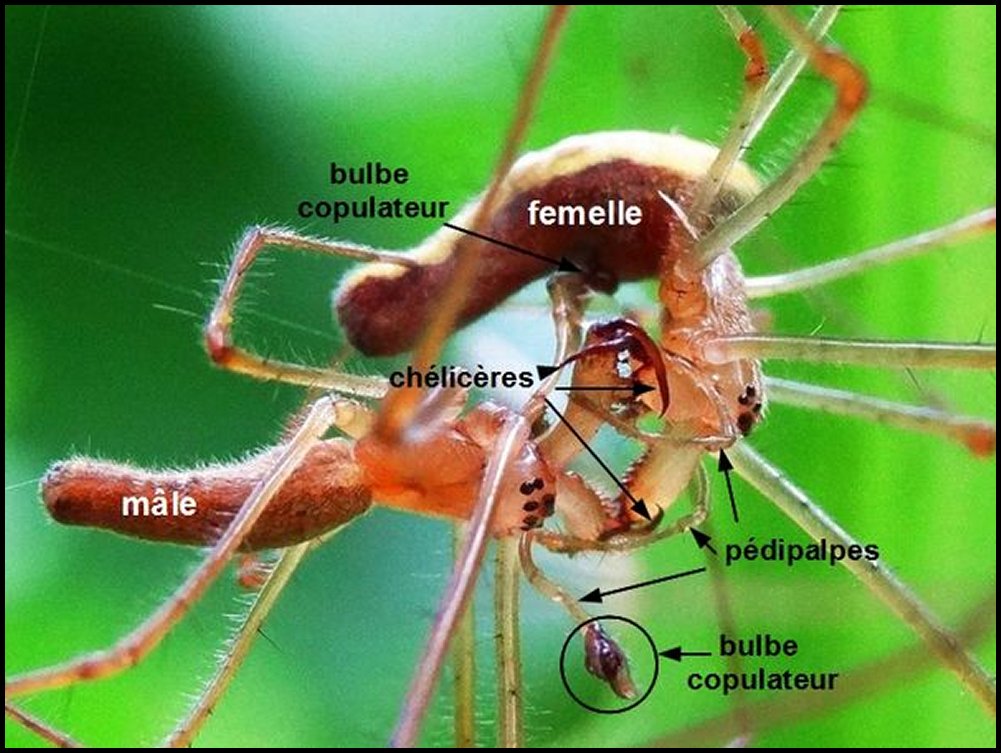 |
| Fig.59 - Tetragnatha
extensa, accouplement. Insertion de l'un des bulbes copulateurs.
Le mâle enserre avec ses chélicères ceux de la
femelle pour la neutraliser. Emprunté sur Internet à ainvo.fr |
L'éjaculation secondaire procèderait d'un mécanisme inverse : émission brutale d'une sécrétion abondante qui emplit la chambre palpaire externe, traverse l'endocuticule, refoule l'épicuticule, rend ses replis turgescents, réduit d'autant le volume du réservoir, y provoque une hyperpression et en chasse ainsi le contenu gamétique. Dans les cas où elle envahit la lumière, cette même sécrétion dilue le sperme, le fluidifie et joue en outre un rôle lubrificateur pendant l' accouplement. Ainsi, chez Telema tenella, la circulation liquidienne que ne semble entraver aucun obstacle serait en rapport vec l'existence d'un spermatophore volumineux et en faciliterait la mobilisation. Hersilia représente un cas «intermédiaire» complexe car son receptaculum montre à la fois des replis et des perforations épicuticulaires ; il permettrait à la fois un passage direct de liquide et l'augmentation de volume des replis. Dans le cas des Argyrodes où l' épicuticule semble pourtant continue, il est possible qu'une sécrétion gagne la lumière du réceptaculum seminis en une zone pariétale indéterminée et soit à l' origine de l'obturateur amorphe (« mating plug») que le mâle met en place durant la copulation.
Il ressort de
cette étude
que le transfert spermatique fait intervenir un jeu subtil de pressions
et dépressions provoquées dans le
tube séminifère par les
déplacements de la
sécrétion épithéliale dont le
rôle essentiel est bien ainsi mécanique.
En
ce qui concerne les hematodochae propres aux Entélégynes, il semblerait
que leur
dilatation par l'hémolymphe ne provoque pas
une
compression du bulbe, à paroi
résistante,
mais plutôt une extrusion de l'embolus
et
l'érection des autres sclérites ; ainsi assureraient-t-
elles une
meilleure coaptation du palpe
mâle avec l'épigyne
femelle
et ses structure annexes.
4.c - Au
point de vue
systématique,
des
différences parfois considérables se
manifestent entre
les 9 espèces, et donc familles, étudiées
comparativement. Malgré
les difficultés
techniques de son étude, l'ultrastructure
du tube
séminifère peut apporter une aide
complémentaire
non négligeable dans l'établissement
ultérieur
d'une classification des Araignées plus
cohérente, au
même titre que le tégument
et ses poils,
normaux
ou spécialisés
(Lehtinen,
1975).
Les
caractères ultrastructuraux des Aranéides sont
en
effet moins impliqués dans l'adaptation à l'environnement
que les caractères «macromorphologiques»
(Lehtinen,1978). Ils
paraissent
spécialement utiles pour
définir les taxons au niveau
familial, plus rarement générique : la cuticule
de
Nemesia
peu différente de la «chitine»
tégumentaire, celle
de
Leptoneta
imperforée mais dont l'endocuticule est
remarquablement épaisse, une paroi
très fine réduite à la seule épicuticule chez Telema
tenella,
les
pores complexes
et les poches
épithéliales de Segestria,
les
pseudo-acini
d' Hersilia
ainsi que les culs-de-sac
décrits chez Araniella
et Argyrodes
doivent
être caractéristiques de
leurs familles respectives (Ctenizidae,
Leptonetidae, Telemidae, Segestriidae, Hersiliidae,
Araneidae, Theridiidae). L'aspect histologique
présenté
par le
tube
séminifère des
autres genres ou espèces appartenant à ces
mêmes groupes taxonomiques
laisse
en effet présager par
extrapolation une
structure fine semblable.
La
famille des Telemidae
apparait notamment comme bien
distincte de celle des Leptonetidae, auxquels Fage
(1913) les avait rattachés, car elle possède
non
seulement un tube
séminifère
beaucoup
plus simple, mais aussi une seule spermathèque originale et
surtout des gamètes
mâles «conditionnés»
dans un spermatophore.
4.d
- Au
point de vue
phylogénique enfin,
il semble bien
exister une relation entre l'ultrastructure du tube
séminifère et certains groupements familiaux,
considérés souvent comme trop artificiels par
les arachnologistes :
Cribellates
et
Ecribellates,
et surtout, Haplogynes
et Entélégynes.
Seule représentante ici
des Orthognatha ou Mygalomorphae considérés
comme plus «primitifs» que les
Labidognathes (Araneomorphae), Nemesia
caementaria
possède un receptaculum à épithélium
glandulaire
«normal» mais à composante
cuticulaire peu
différenciée. Avec de grands pores
canaux,
cette dernière se rapproche beaucoup plus du tégument,
dont elle n'est qu'une «invagination»
embryologique,
que le tube
chitineux des
autres espèces.
De son côté, Zosis
geniculatus, le seul Cribellate
que nous ayons
étudié, possède
des replis
épicuticulaires
comme
les
Ecribellates
Araniella et Argyrodes. Ces replis se présentent donc
comme un nouveau caractére
homologue ou synapomorphique ; il confirmerait une
théorie selon
laquelle le deuxième groupe s'apparenterait plus étroitement aux
Araignées cribellates
qu'on ne
l'admet d'ordinaire et pourrait bien en
dériver.
Chez les Haplogynes (Telema,
Leptoneta, Pholcus, Segestria), le bulbe
du
mâle est dépourvu d' haematodocha et montre en
général une
simplification parallèle de la cuticule
réceptaculaire. Sa
paroi «chitineuse» est en
effet réduite à la seule épicuticule
(Telema),
dépourvue de perforations (Leptoneta),
ajourée par de
larges pores (Segestria) ou
formée de couches assez
peu différenciées (Pholcus). Une telle
simplification
pourrait être
mise en parallèle avec celle des voies
génitales femelles.
Chez les Entélégynes, le bulbe
copulateur est
pourvu d'une ou
plusieurs haematodocha(e). La
cuticule de son receptaculum
est épaisse, rigide,
ajourée par des
fenestrations transversales
et surtout, comporte une épicuticule continue.
La simplification de la
cuticule
réceptaculaire des
Haplogynes mâles pourrait être mise en
parallèle
avec celle des voies
génitales de
leurs
partenaires. De même, les caractères
particuliers
de cette cuticule chez
les Entélégynes, permettent de
supposer que
la pression qu'elle
assure en cours d'éjaculation
secondaire surmonte
les résistances de voies
génitales femelles
souvent
très complexes.
Note 1 : Laboratoire CNRS, Moulis 09200 : fixation des parties étudiées au glutaraldéhyde à 2,9% dans le tampon Millonig 0,2 M, post-fixation au tétroxyde d'osmium à 0,2% dans le même tampon, et inclusion en épon ; coupes fines au microtome Reichert OM U2 contrastées par l'acétate d'uranyle, le citrate de plomb et examinées ensuite sous 50 KV, au microscope Sopelem du Laboratoire souterrain. Travail effectué avec Lysiane Juberthie-Jupeau, directeur de recherches au CNRS, et ses collaboratrices.
Note 2 : Cet article n'a pas été
proposé à "Wikipédia" dont les
présentations du Pédipalpe (https://fr.wikipedia.org/wiki/P%C3%A9dipalpe) et du bulbe
copulateur (https://fr.wikipedia.org/wiki/Bulbe_copulateur)
sont indigentes, ne comportant strictement aucune donnée
sur
leur structure fine, pourtant d'intérêt
capital. Les liens
externes vers le présent article qu'André
Lopez avait bien voulu inclure pour
"sauver la mise" alors qu'il était encore rédacteur
de
l'Encyclopédie, ont été
délibérément
détruits par ses
"utilisateurs""wiki".
LIENS
EXTERNES
https://www.european-arachnology.org/esa/wp-content/uploads/2015/08/097-109-Lopez.pdf
https://zims-lfr.kiwix.campusafrica.gos.orange.com/wikipedia_fr_all_maxi/A/Bulbe_copulateur
Bibliographie
Chamberlin,R.V. &
W.Ivie, 1934.- Bull.Univ.Utah,
vol.24, p.1-18.
Comstock,H.,1912.-
The Spider Book, Doubleday,
New-York, 721
pp.Cooke, J.A.L.,1966.-
Senck.Biol.,47, p.35-43
Foelix,R.F,1982 - Biology of Spiders. Harvard University Press, 306 pp.
Harm,M.,1931.-
Zeits.Morph.Tiere, 22, 4, p.629-670.
Lamoral,B.H.,1973.-
Ann.Natal.Mus., 21, 3,
p.609-648.
Lopez, A.,1974b.-
C.R.Acad.Sci.Paris,
t.278 (4 mars 1974),
série D, p.1373-1376.
Lopez,A.,1977a.
- Rev. Arachnol., 1, 1, p. 7.
Lopez,A.,1977b.- Contribution
à l'étude des caractères
sexuels somatiques chez
les mâles d'Aranéides.
Thèse doct.Etat es.
Sciences, Univ.Sci.Tech., Montpellier, Avril 1977, 117 pp.
Lopez,A.,1980d
(avec C.Juberthie).- C.R.Veme Coll.Arach.,Sept.1979, Barcelona, 1980,
p.111-117.
Lopez,A.,1981 (avec L.Juberthie-Jupeau).-
Revue Arachnol., 3 (2), 1981,
p. 65-73
Lopez,A.,1982(avec L.Juberthie-Jupeau).-
Bull.Soc.Et.Sci.nat.Béziers, N.S., VIII (49), 1980-1981,
p.12-19.
Lopez,A.,1985 (avec L.
Juberthie-Jupeau) .-
Mém. Biospéol.,
XII,
p.97-109.
Millot,J.
1968.- Ordre des Aranéides in Traité
de Zoologie,
P.P.Grassé édit., Masson, p. 589-743.
Noirot,
Ch. & A.Quennedey, 1974.- Ann.Rev.Entomol.,19, p.61-80.