canal déférent
spermatophore des Telemidae
|
|
| Couleurs
conventionnelles : En noir et italiques, termes anatomiques ; en violet,,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
orange,, parties
les plus importantes
et résumés; en bleu, liens divers.
|
|
Abréviations
conventionnelles :
M.E.B. : (photographie en) microscopie électronique à balayage M.E.T. :
(photographie en) microscopie
électronique à transmission
C.H. : coupe histologique
(microscopie photonique)
|
1- Introduction
2-Histologie
3- Ultrastructure
2-1- Déférent
2-2- Spermatozoïdes
2-3-Spermatophore
4-Commentaires
1 - Introduction
Entre autres organes, elles ont porté sur le testicule, le canal déférent du mâle, la spermathèque de la femelle et, dans les deux sexes, sur les spermatophores.
 |
|
L'auteur récoltant au pinceau Telema
tenella pour sa toute
première étude histologique et
la découverte
de spermatophores en Aranéologie (Grotte de Can Brixot, La
Preste, P.O.)
(© Salvayre, ., d'après
une diapositive)
|
Dans le cadre des ultrastructures, l'auteur a également étudié et décrit chez ces mêmes Telema tenella et en collaboration, le tractus génital mâle, la spermathèque de la femelle (1983b), les glandes à soie (1983c) et les glandes coxales (1983d).
2 - Histologie
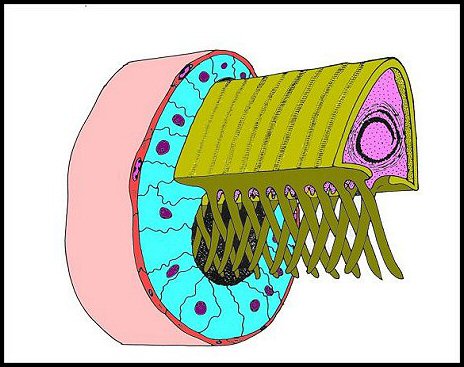
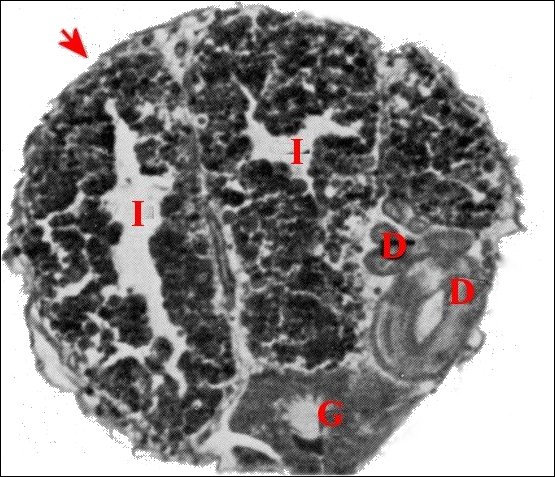
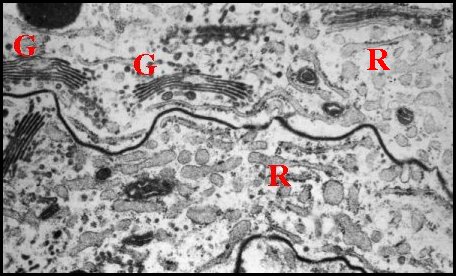
Issus d’une paire de testicules subsphériques (Fig.2,3), les déférents sont deux longs canaux très sinueux (Fig.2 à 4), convolutés, s’unissant sur la ligne médiane en un conduit terminal commun ouvert au gonopore, dans le sillon épigastrique. L’ensemble des canaux est comparativement plus gros et surtout plus épais que dans les autres familles d’Araignées, les Ochyroceratidae par exemple (Fig.1) . Avec son contenu, il forme un massif volumineux, long d’environ 250 µm chez un mâle de 1,3 mm et occupe ainsi toute la partie antéro-ventrale de l’abdomen (Fig.2 à 4).
 |
 |
| Fig.1 - Ochyrocera
peruana, mâle : coupe d'abdomen |
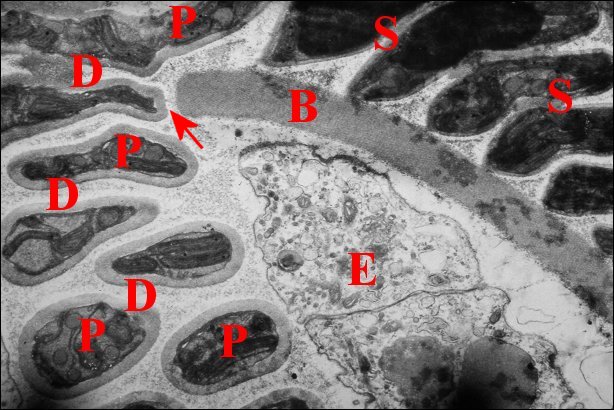
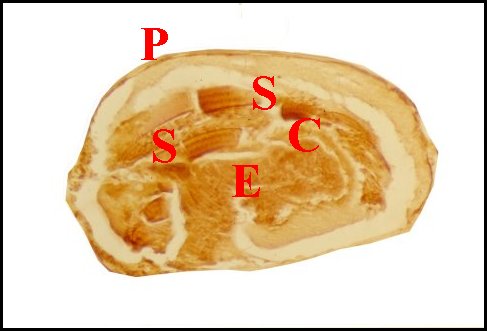
Fig.2 - Telema mâle : coupe transversale de l'abdomen |
| D, sections
du déférent ; E, épithélium de ce
canal ; G, glande à soie ; I, diverticules intestinaux ; M,
muscle abdominal ; S, spermatozoïdes dans la lumière ; V, tégument ventral. Flèche : face dorsale (© A.Lopez C.H.) |
|
 |
 |
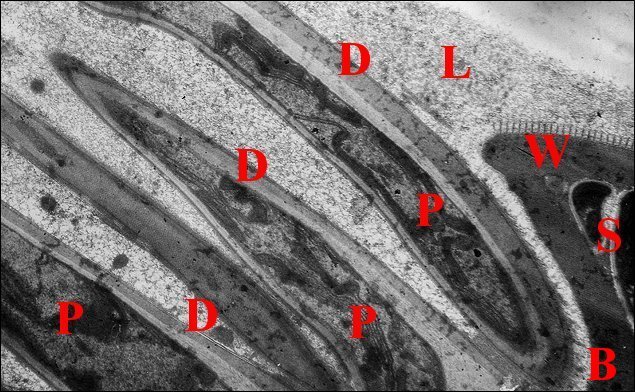
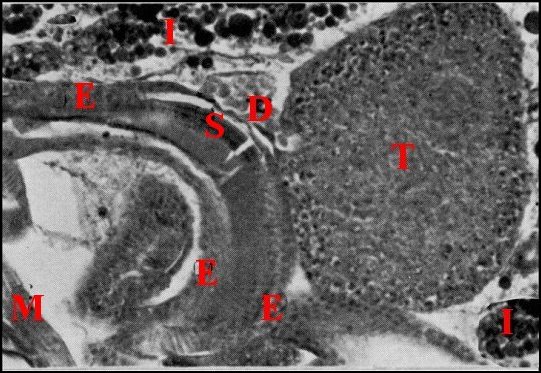
| Fig.3 - Telema mâle : coupe parasagittale de l'abdomen | Fig.4- Autre coupe parasagittale de l'abdomen |
| D, origine
du déférent ; E, épithélium de
ce canal ; G,
glandes à soie ; I, diverticules intestinaux ; M, muscle
abdominal ; S, spermatophore ; T, testicule (© A.Lopez C.H.) |
|
Chaque
déférent
contient une substance amorphe, des
spermatozoïdes et, dans sa partie distale ou terminale
différenciée, une formation
tubuleuse
brun-jaunâtre, large d’environ 18 µm, triangulaire
en coupe
transversale, évoquant un «étui» et
pourvue de grêles expansions
latérales. Les
gamètes
se logent dans ce spermatophore,
superposés en
« pile d’assiettes » ou groupés
comme les
érythrocytes dans un capillaire de
Vertébré
(Fig.7,8,12). Revêtant avec ses expansions
un aspect
caricatural de «Myriapode », le spermatophore se
retrouve, apparemment tel quel, dans les coupes histologiques du palpe mâle (Fig.5), plus
précisément de son bulbe
(Fig.5 à 8) et, chez la
femelle, dans la spermathèque (Fig.9
à 11).
 |
 |
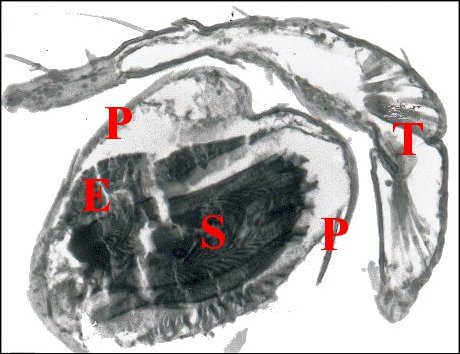
| Fig. 5 - Palpe de Telema
mâle, son bulbe et le spermatophore |
Fig.6- Même bulbe (isolé, retourné) et spermatophore |
| C, "vésicule" cuticulaire ; E,
épithélium en "coussinet" ; P, paroi bulbaire ; S,
spermatophore ; T, tibia et tarse (© A.Lopez C.H.) |
|
 |
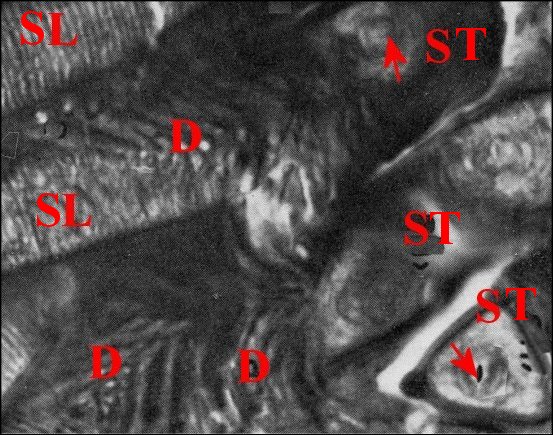 |
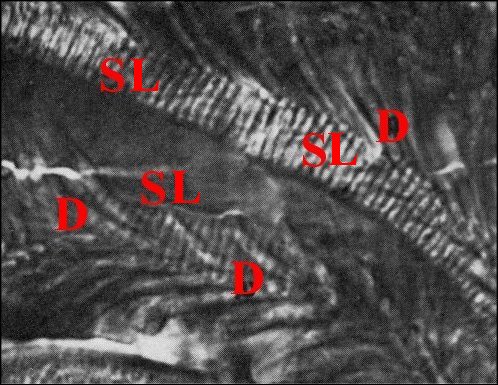
| Fig.7 - Autre bulbe de Telema mâle et spermatophore avec ses digitations, en vue longitudinale de deux replis |
Fig.8
- Le même, autres vues longitudinales et deux coupes
transversales en bas et à droite
|
| D,
digitations ; SL, spermatophore en coupe longitudinale avec les
gamètes empilés, vus de profil ; ST, spermatophore en
coupe transversale avec les gamètes fléchés
(© A.Lopez C.H.) |
|
 |
 |
|
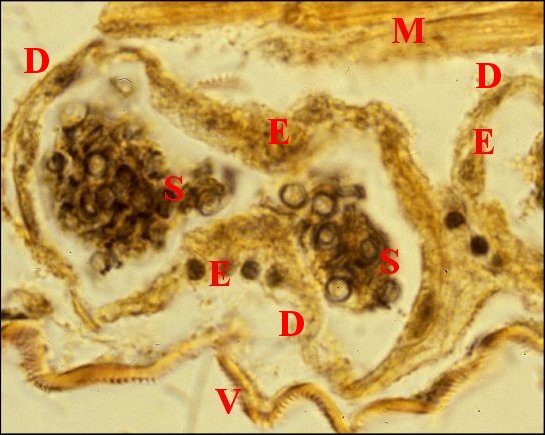
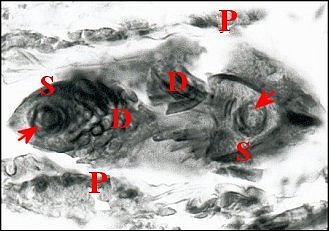
Fig.
9- Spermathèque de Telema
femelle et le spermatophore
en
coupes transversales et tangentielle
|
Fig.
10 - Autre spermathèque de
Telema
femelle
en coupe transversale et le spermatophore |
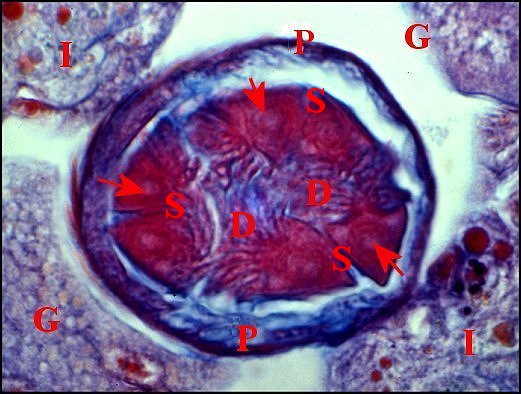
| D, digitations du spermatophore ; G, glandes à soie ; I, diverticule intestinal ; P, paroi de la spermathèque ; S, coupes du spermatophore . Flèches : gamètes lovés dans ce dernier (© A.Lopez C.H.) | |
 |
|
Fig.11
- Autre spermathèque de
Telema
femelle et le spermatophore en
coupe longitudinale
|
|
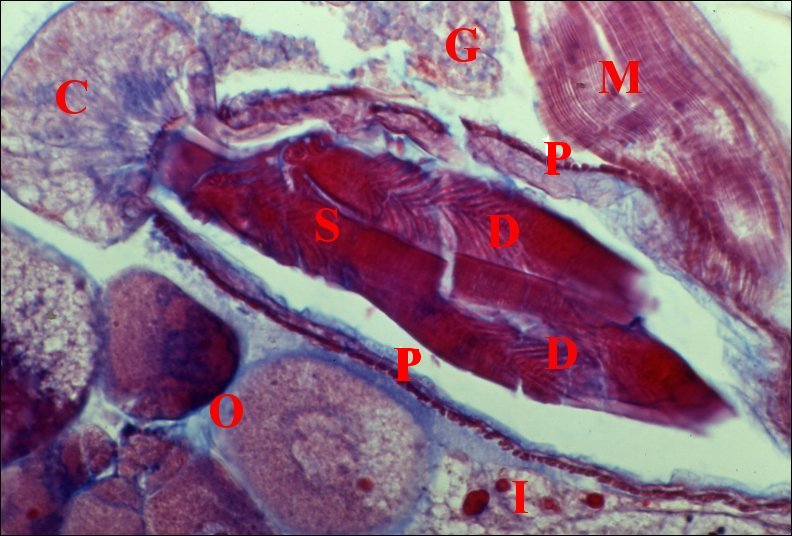
C,
fond de la spermathèque et son coussinet glandulaire ; D,
digitations du spermatophore ; G, glande à soie ; I, diverticule
intestinal ;M, muscle ; O, ovocytes ; P, paroi de la spermathèque
(© A.Lopez C.H.)
|
La structure du déférent
n’est pas uniforme. Ce conduit montre en effet une portion
proximale sinueuse dont l’épithélium, très bas,
rappelle un revêtement
endothélial, une portion
intermédiaire à cellules
plus hautes (Fig.12) et
une partie
différenciée plus
longue et
complexe. Renfermant le spermatophore,
cette dernière est
formée par des cellules
prismatiques beaucoup plus grandes,
surtout ventralement (hauteur : 30 µm) et à noyaux
ovoïdes très apparents.
 |
|
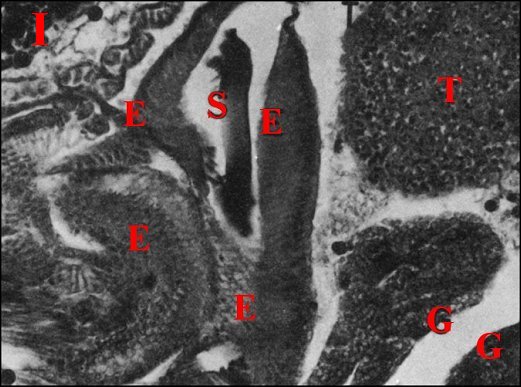
Fig.12-
Déférent
(partie intermédiaire) et spermatozoïdes
non encore inclus dans un spermatophore
|
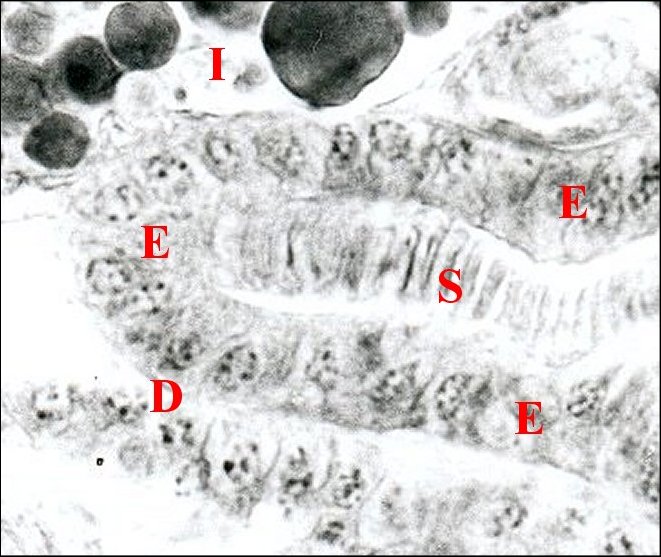
| D, déférent pelotonné
; E,
son épithélium ; I, intestin ; S, gamètes en "pile
d'assiettes" (©
A.Lopez C.H.) |
Chez Apneumonella sp., l'auteur
pu étudier que la spermathèque,
conformée en gros comme celle de
Telema tenella. L’unique femelle
observée s’étant accouplée, sa lumière
renfermait une substance homogène amorphe et
surtout, un grand spermatophore
jaune-rougeâtre, lové sur lui-même et
contenant
aussi des gamètes qui
s’y empilent « comme les
comprimés dans leur étui ». Il diffère
toutefois de celui de Telema
par son aspect cylindrique, avec une cavité
axiale régulière
et l’absence complète de digitations
( Lopez,1978
)(Fig.13, 14).
 |
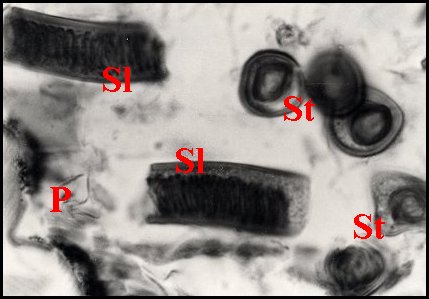 |
| Fig.13
- Spermatophore
d'Apneumonella sp. dans la spermathèque |
Fig.14
- Détail du spermatophore (coupes longitudinaleset transversales) |
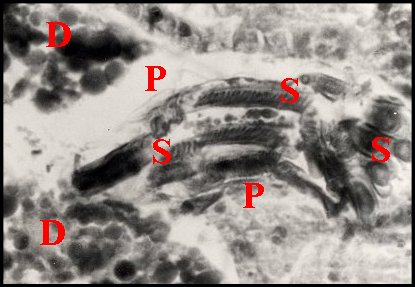
| D, diverticules intestinaux ; P, paroi de la spermathèque ; S, spermatophore ; Sl, coupe longitudinale ; St, coupe transversale du précédent (© A.Lopez C.H.) | |
3- Ultrastructure
Outre son épithélium
interne, la paroi
du déférent
montre
au M.E.T. une lame
basale et une couche de fibres
musculaires dont le
hyaloplasme contient des
faisceaux de myofibrilles
caractéristiques isolés.
L'épithélium
est simple, prismatique et sécrétoire. Ses cellules sont
solidarisées par
des zonulae adherens
sub-apicales et de longues jonctions
septées.
Sa lumière
est large,
arrondie et régulière dans la portion
proximale, puis ovale au début de la partie
différenciée ou portion intermédiaire
(Fig.3), pourvue enfin d’une gouttière
ventrale lui
conférant un curieux aspect en « as de
pique » dans le reste de la partie
différenciée ou portion distale. Il
s’ensuit qu’au niveau de cette dernière la paroi
déférentielle présente une zone dorsale
mince et
une zone ventrale ou accessoire plus épaisse (Schéma 1).
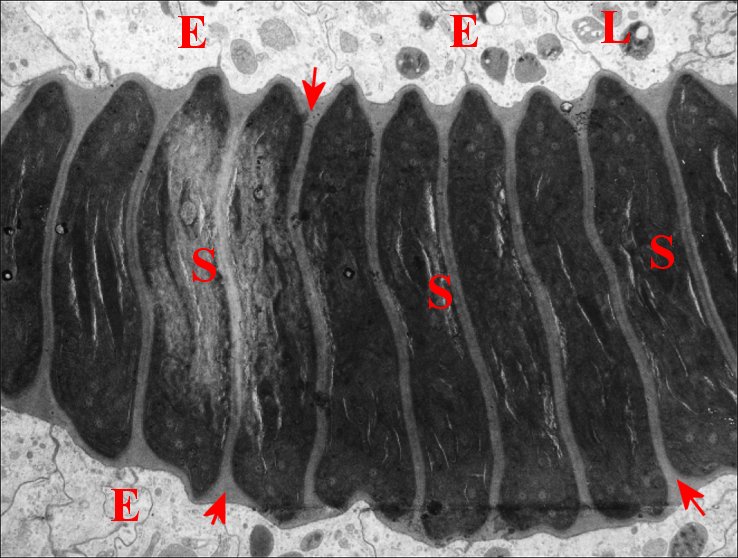 |
| Fig.15 - Déférent, portion
proximale coupée en long. |
| E, cellules épithéliales ; L, lysosomes ; S, spermatozoïdes. Flèches : sécrétion s'insinuant entre les gamètes empilés (© A.Lopez M.E.T.) |
Dans la partie
différenciée, les cellules
épithéliales sont
plus hautes,
uniformément (portion
intermédiaire), et
surtout dans la zone ventrale
de la grande portion distale (Schéma
1). Leur noyau
central renferme
une
chromatine fine et
dispersée (Fig.16). Le réticulum
endoplasmique est formé par de nombreuses cisternae lisses et
granulaires (Fig.16,18) dont dérivent des vésicules
à
contenu peu
contrasté. L'appareil de
Golgi
est
remarquablement
développé (Fig.17,18). Il se compose
d’empilements
sacculaires ou dictyosomes surtout
nombreux dans la zone
dorsale et élaborant
une grande quantité de vésicules
à contenu opaque. Les mitochondries sont
peu nombreuses et pourvues de crêtes
parallèles. Les vésicules
golgiennes et réticulaires libèrent
leur
contenu dans
la lumière au
niveau des pôles apicaux.
Il s’y fusionne avec la sécrétion provenant de la
partie
proximale pour former un matériel granuleux positif à
l’APS et à la tétrazoréaction de Danielli, donc
glycoprotéique (Lopez,1981c).
*
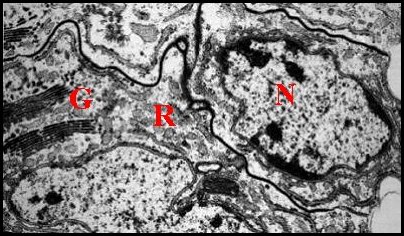 |
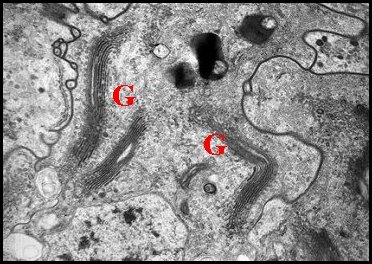 |
 |
| Fig. 16 - Cellules épithéliales glandulaires du canal déférent | Fig 17 - Détails : complexes de Golgi | Fig. 18- Autres détails : Golgi, réticulum |
| G, dictyosomes de l'appareil de Golgi ; L, Lysosomes ; N, noyau ; P, plasmalemmes ; R, réticulum endoplasmique (© A.Lopez M.E.T.) | ||
2.2-Spermatozoïdes
Les spermatozoïdes mûrs
se sont formés dans le testicule à partir de spermatides d’abord polymorphes et
amiboïdes, puis polarisées, pourvues d’un noyau allongé,
enfin flagellées
(Lopez,1981c). Chacun d’eux est
entouré par une capsule
ou coque d'enkystement
glycoprotéique
(Fig.19,25,27) semblable à celle des autres Araignées et peu
condensé. Son cytoplasme est abondant, aucune phase
d’élimination cytoplasmique n’ayant
été clairement observée au cours de la
spermiogénèse ;
il est très riche en
mitochondries à crêtes concentriques
(Fig.19), en vésicules
ovoïdes et en membranes
enchevêtrées d'origine golgienne vraisemblable. Le noyau et la baguette
acrosomienne sont étirés et enroulés sur
eux
mêmes, le premier suivant 1
tour et
demi ou 2. L'axonème,
de type 9 + 3 comme chez les autres Araneides (Fig.20), est
rétracté dans le cytoplasme où il s’enroule
sur 4
à 5 tours (Fig. 19). De plus,
chaque
gamète montre un
« prolongement » qui
pénètre dans une
digitation, y
est
accompagné par la capsule
et renferme lui aussi des organites
(vésicules, amas
parallèles de membranes
sinueuses, mitochondries)
(Fig.21,22).
 |
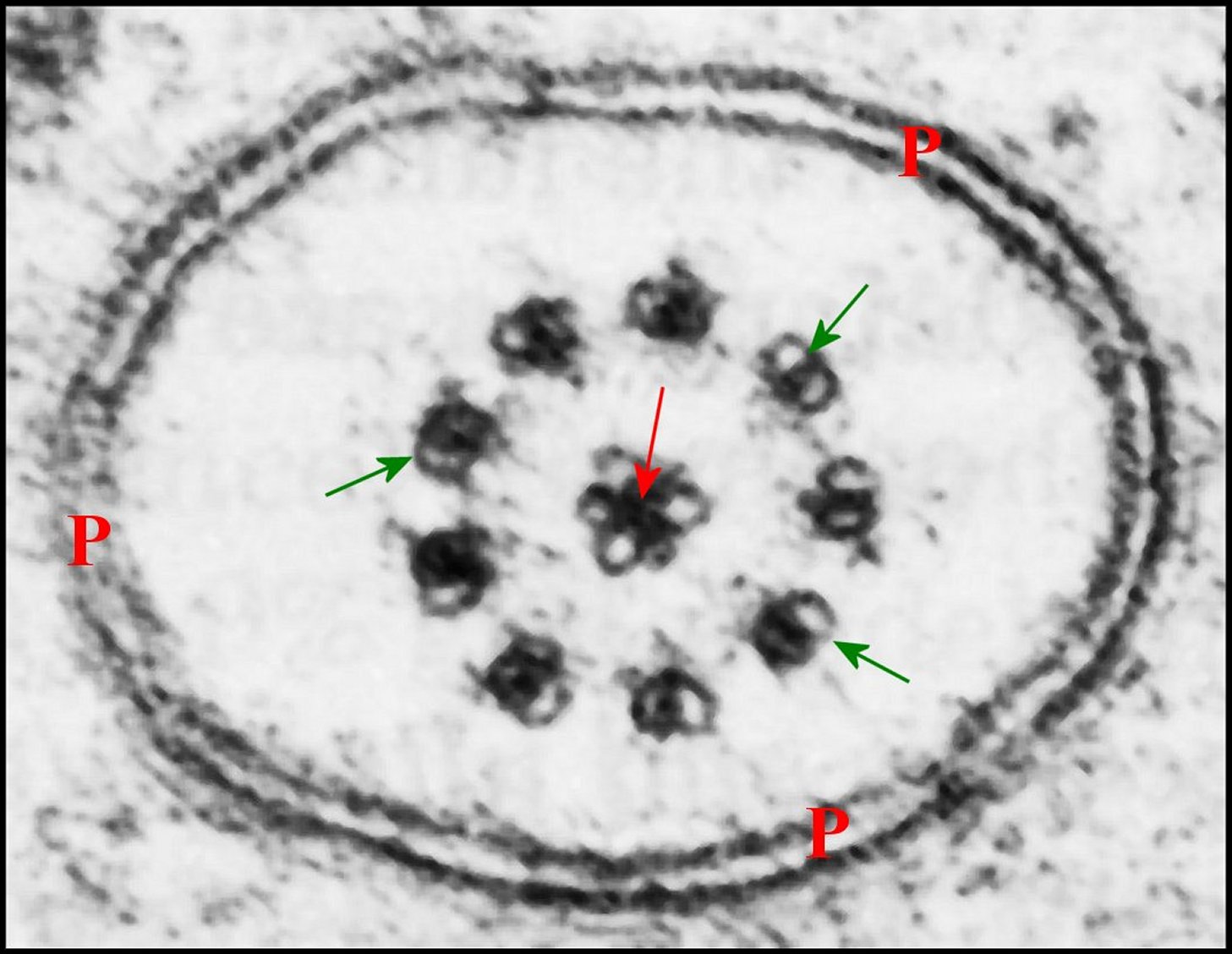 |
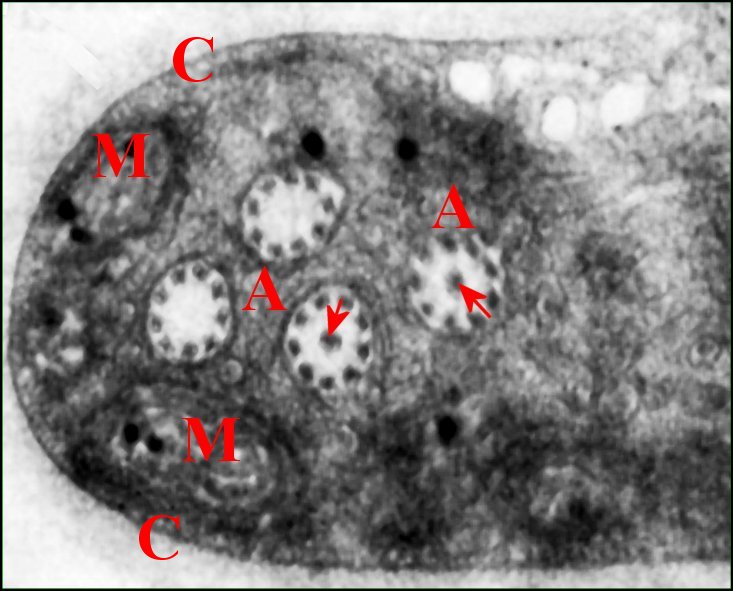
| Fig.19 - Spermatozoïde et son
axonème rétracté |
Fig.20 - Coupe isolée
d'axonème flagellaire et ses tubules |
| A, axonème replié 4 fois dans le cytoplasme ; C, capsule ; M, mitochondries ; P, membranes plasmique invaginée et flagellaire. Flèches rouges: triplet tubulaire axial. Flèches vertes : doublets périphériques (© A.Lopez M.E.T.) | |
2.3 - Spermatophore
Le spermatophore s’individualise
dans la portion
distale
où son élaboration
paraît continue. Il a bien la
forme insolite
d’un
étui prismatique triangulaire (Schéma
1), avec deux
grandes faces latérales un peu convexes et une face
basale plus réduite, légèrement concave. Il
est ouvert à ses deux extrémités et selon une
génératrice, au niveau de la même base qui
montre donc une déhiscence longitudinale lui conférant
aussi un aspect en gouttière (Schéma 1,
Fig.22).
La paroi du spermatophore est
elle-même formée
par 3 couches
superposées, interne, moyenne et externe à
l’exception
toutefois des bords basaux (Fig.22,23) et des digitations
(Fig.21,22) qui n’en ont qu’une
seule, l’interne (Lopez,1981c).
.
 |
 |
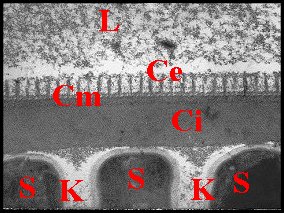 |
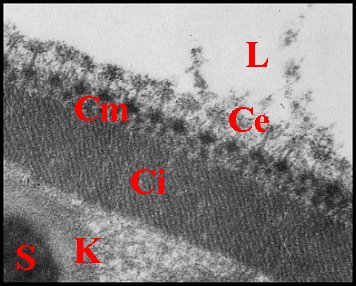
| Fig. 23 - Coupe
transversale du spermatophore dans le déférent |
Fig.24-Détails
de sa paroi en formation |
Fig. 25-
Détails de sa paroi définitive |
| B, base avec sa fente ; Ce, couche externe ; Ci, couche interne ; Cm, couche moyenne ; E, épithélium et L, lumière du déférent ; K, coque d'enkystement et P, prolongement de spermatozoides (S) (© A.Lopez M.E.T.) | ||
Cette couche interne est
la
plus épaisse (0,45 µm) et possède une
structure paracristalline (Fig.24,25). Elle semble striée dans
les coupes transversales (Fig.24) mais montre dans les longitudinales
et axiales un réseau polygonal
trés régulier,
en «nid d’abeilles», dont chaque élément
constitutif
est centré par une fibre dense. La
distance
moyenne entre 2 fibres est de 75 Å (Fig.26).
 |
| Fig.26-
Réseau en "nid d'abeilles". Flèches : fibres denses
centrales (© A.Lopez M.E.T.) |
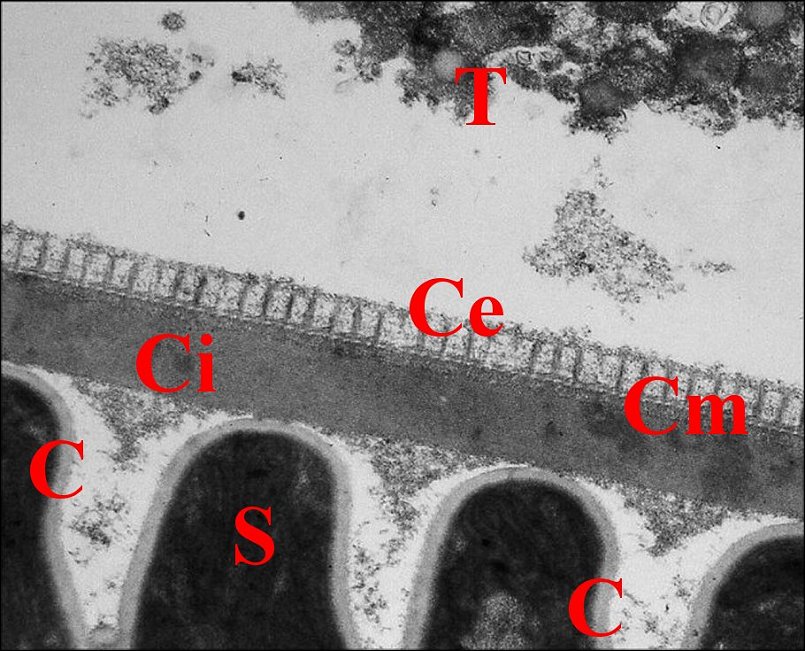 |
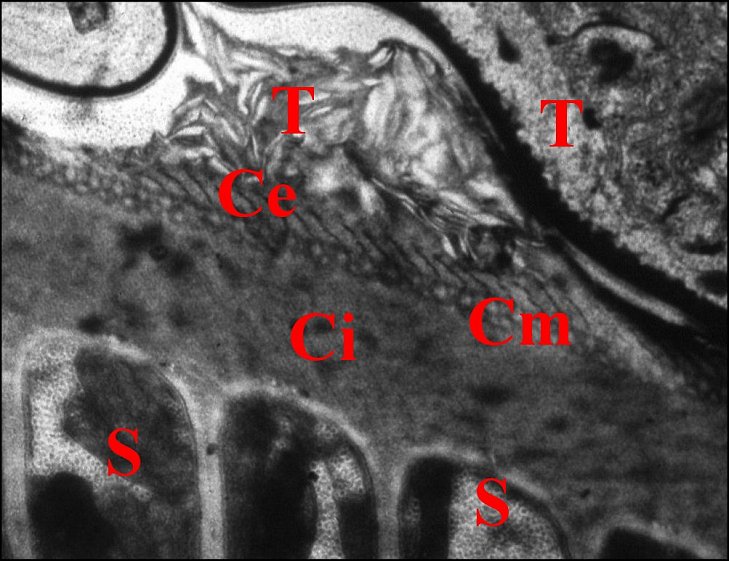 |
| Fig.27 - Coupe du spermatophore dans la
spermathèque |
Fig.28 - Autre coupe à un stade
ultérieur |
| C, coque ou capsule d'enkystement ; Ce, couche externe ; Ci, couche interne ; Cm, couche moyenne ; S, spermatozoïde ; T, paroi de la spermathèque et sécrétions (Fig.28) (© A.Lopez M.E.T.) | |
La couche moyenne ou intermédiaire est beaucoup plus mince (500 à 600 Å) et formée par des agrégats de matériel dense lui donnant un aspect hétérogène alvéolé (Fig.24,25).
La
couche externe, qui est la
plus originale, se
présente comme
un ensemble de piliers étroits (diamètre = 150 Å),
d’abord
bas et granuleux dans la paroi en formation (Fig.24)
puis plus hauts (0,2 µm) et homogènes
(Fig.25). Ils s’alignent en séries parallèles perpendiculairement à l’axe de la
gouttière et sont ainsi responsables d’une striation
transversale.
Cette ultrastructure est retrouvée dans la spermathèque
lorsque le spermatophore y a
été introduit (Fig.27,28),
d'abord inchangée (Fig.27) puis avec des modifications
portant sur la couche interne
(aspect
"flou") et la couche externe
(inclinaison des piliers un même sens)(fig.28). La couche moyenne
parait
plus nette tandis que la capsule
ou coque d'enkystement
gamétique semble s'effacer (Fig.28). De plus, dans la lumière du sac de la spermathèque,
l'ensemble du spermatophore présente
un agencement particulier déduit des coupes histologiques
: il est replié sur lui-même en "épingles à cheveux"successives ébauchant une
curieuse symétrie rayonnée (Lopez,1979)
Le "prolongement" de chaque spermatozoïde
pénètre avec sa capsule
dans une digitation formée
par la seule couche interne
et qui l'englobe comme un petit étui
individuel (Fig.21,22).
4 -Commentaires
Sur le
plan anatomique, le
canal déférent de Telema tenella est remarquable par son volume, son
intense
activité sécrétoire d’origine golgienne et le
fait qu’il
élabore une structure ayant bien
tous les caractères d’un spermatophore. Bien
que ce
dernier ne soit pas un produit de
glandes annexées à
l’appareil
génital et n’ait pas la forme de capsules
closes, plus ou moins complexes, souvent pédiculisées
comme
chez les autres Arthropodes (dont
les Scorpions et Pseudoscorpions
parmi les Arachnides), il n’en
présente pas moins les particularités
essentielles de ce type d’ « appareil ».
Il s’agit en effet d'une formation autonome, bien individualisée, régulière et géométrique, en gouttière digitée, possédant une paroi propre à ultrastructure complexe, monolaminaire dans sa face basale et les digitations, trilaminaire ailleurs, avec une couche paracristalline et les curieux "piliers" externes.
Une telle organisation fait
défaut chez toutes les autres Araignées, y compris celles qui présentent des
« aggrégats » de spermatozoïdes
comme les Dysderidae
("sphérulation"
: Lopez,1972) (Fig.
29), les Filistatidae et même certains Mygalomorphes dont les gamètes
se groupent
à plusieurs dans une
même coque d'enkystement (Nemesia, M.E.T.: Lopez,1981d). Décrivant de semblables
"aggrégats" dans le cadre de ses "coenospermies", Alberti (1988)
y a inclu aussi les spermatophores des
Telemidae,
considérés par lui comme une simple forme
« complexe » des précédentes. Les
ultrastructures observées chez Telema
tenella invalident
définitivement cette opinion critique de l 'auteur italien.
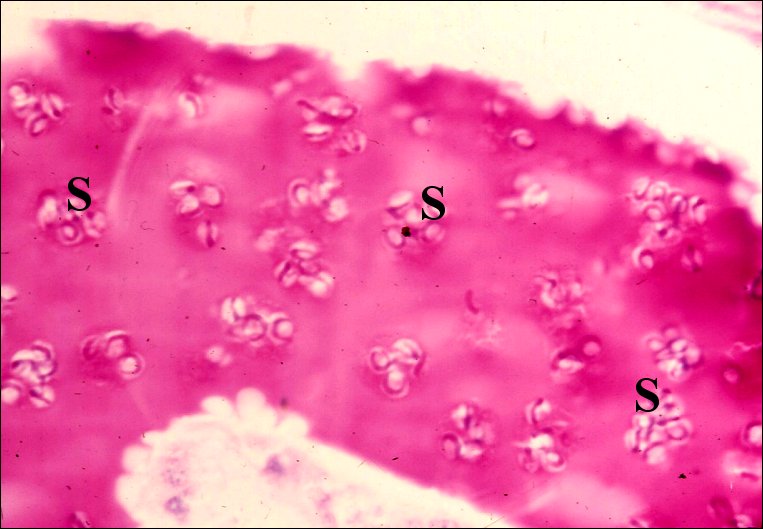 |
|
Fig.
29 - Dysdera
erythrina, mâle. Contenu du déférent avec
ses "aggrégats" de spermatozoïdes (S)
(© A.Lopez C.H.) |
Les spermatozoïdes
empilés dans le spermatophore
ont des
caractères
semblables à ceux des autres Araignées (capsule
glycoproteinique individuelle,
triplet axial,
rétraction de l’axonème
enroulé comme le noyau),
mais en diffèrent
néanmoins parce qu’ils conservent tout le cytoplasme
de la spermatide.
Sur le plan fonctionnel, le
spermatophore représente pour les gamètes mâles un
«conditionnement»
ou appareil
d’ «emballage»
renforçant leur protection déjà assurée par
les capsules individuelles tout en leur permettant de progresser vers
l’aval et le gonopore. Ce
cheminement dans le déférent
pourrait être facilité non seulement par la contraction des
muscles pariétaux, par l'
"accrochage" des digitations à
la paroi du canal bien qu’elles
ne
présentent pas d’ultrastructure motrice et par
la
striation transversale jouant également
un rôle mécanique.
Le spermatophore est
initialement produit par le canal
déférent sur un mode
ininterrompu, semble bien
ouvert à ses deux extrémités et doit
donc subir un
« tronçonnement » ultérieur lors de
la « transmission spermatique ». Bien qu’il n’ait jamais
été observé, ce processus existe sans aucun
doute . Lors de
Sur le plan phylogénétique,
l’élaboration et
l’usage d’un spermatophore chez Telema tenella et probablement aussi
chez les autres Telemidae apparaissent comme le maintien d’un caractère
archaïque. Alexander
et Ever (1957) avaient d’ailleurs
envisagé son existence chez les Araignées
primitives et sa perte ultérieure dans le tissage
de la toile lors de
l’évolution .
Cette dernière hypothèse ne paraît toutefois pas
appliquable à Telema car
elle
construit des cocons
ovigères et un édifice
soyeux en nappe assez perfectionnés. D'autre part et
comme l'auteur l'a déjà évoqué alors qu'il
ne connaîssait pas encore Telema
tenella (Lopez,1977b), le spermatophore
des autres
Araignées pourrait avoir été remplacé, en
cours d’évolution, par le produit sécrétoire des glandes épigastriques
qui serait alors son équivalent.
Sur
le plan
systématique
enfin,
il apparait que grace au spermatophore :
►
les genres
Telema et Apneumonella peuvent être
rapprochés l’un de
l’autre
dans le cadre d’une parenté étroite mise en
doute
par Lehtinen (1967) trop axé sur l’appareil visuel (Note 2).
► la famille des
Télémides se trouve ainsi validée,
non
seulement par la structure particulière des organes
génitaux (Brignoli,1973)
mais
surtout par leur contenu.
Note 1 :
Laboratoire CNRS,
Moulis 09200 : fixation des parties étudiées au
glutaraldéhyde à 2,9% dans le tampon Millonig 0,2 M,
post-fixation au tétroxyde d’osmium à 0,2% dans le
même tampon, et inclusion en épon ; coupes fines au
microtome Reichert OM U2 contrastées par l’acétate
d’uranyle, le citrate de plomb et examinées ensuite sous 50 KV,
au microscope Sopelem du Laboratoire souterrain. Travail
effectué avec Lysiane Juberthie-Jupeau, directeur de
recherches au CNRS, et ses collaboratrices.
Note 2 : Une fois de
plus, nous
retrouvons là le caractère superficiel de telles
études et affirmations plus ou moins gratuites où
l’auteur "dérape" moins par absence de moyens techniques (d’autant
plus qu’il est souvent
universitaire et
peut demander l’assistance d’un laboratoire de microscopie voisin) que
par manque de curiosité réelle et méconnaissance
complète de ce que peut apporter l’ histologie, moyen
d’investigation pionnière incomparable mais aujourd'hui encore
(2024) plus que négligé..
Bibliographie
Alberti,
G., 1988. - C.R.XIeme
Coll.Arach.,Août 1988, Berlin, 1988, p.331.
Brignoli,P-M., 1973.- Frag.ent., 8 (5), p.247-263.
Fage,L., 1913.- Arch.Zool.exp.gen.,10 (Biospeologica ,29), p.479-576.Lopez,A.,1972 - Bull.soc.zool.France, 97, n° 2,
p.113-119.
Lopez,A.,1977a.-
Contribution à
l'étude des caractères sexuels somatiques chez les
mâles des Aranéides. Thèse Doctorat d' Etat es
Sciences, Université des S ciences et Techniques du Languedoc,
Montpellier, Avril 1977.
Lopez,A.,1977b
(avec H.Salvayre)- Bull.Soc.Et.Sci.nat.Béziers, N.S, IV, Vol.45,
1976,p. 17-26.
Lopez,A.,1977c.-
Bull.soc.zool.France, 102, n° 3, p.261-266.
Lopez,A.(avec C.Juberthie)1979.- C.R.Veme
coll.Arachnol.Express.Française, Univ.Barcelona, p.111-119.
Lopez,A.,1983a.- Bull.Soc.Et.Sci.nat.Béziers, N.S., IX, Vol.50, 1982-1983, p.20-28.
Lopez,A.,1978
(avec
R.Legendre).- Bull.soc.zool.France, 103, n° 1, p.35-41.
Lopez,A.,1983b
(avec L.Juberthie-Jupeau).- Mém.Biospéol, X, p. 413-418.
Lopez,A.,1983c
(avec J.Kovoor).- Mém.Biospéol, X, p. 419-425.
Lopez,A.,1980d
(avec C.Juberthie).- C.R.Veme Coll.Arach.,Sept.1979, Barcelona,
1980,
p.111-117.
Lopez,A.,1981b
(avec J.Kovoor & M. Emerit).- Atti Soc. Tosc.Sci. Nat., Mem.,
ser.B, 88, suppl., p.53 –60.
Lopez,A., 1981c (avec C.Juberthie & J.Kovoor.)- Intern.Journ.Invert.reprod., 3, p.181-191.
Lopez,A.,1981d(avec L.Juberthie-Jupeau).- Bull.Soc.Et.Sci.nat.Béziers, N.S., VIII (49), 1980-1981, p.12-19.
Petrunkevitch,
A., 1923.-
Ann.N.Y.Acad.Sci.,29, p.145-180.
Ribera, C., &
E.Mateos.,
2000 -Telema tenella
(Simon)(Telemidae) y Argyroneta
aquatica (Clerck)(Argyronetidae), dos nuevas familias de
Araneidos para la Fauna ibérica. Revista ibérica de Aracnologia.
Vol.1,XII-2000, seccion Articulos y Notas, p.61-63[PDF] telema tenella (simon, 1882)
(telemidae)
sea-entomologia.org › PDF › RIA_1
Simon, E.,
1882.- Etudes arachnologiques, 13
eme mémoire. Ann.Soc.ent.France (6) 2, p.204-205.
LIENS
EXTERNES.
https://www.jean-marc-gil-toutsurlabotanique.fr/page/introduction-a-la-botanique/glossaire-botanique/glossaire/spermatophore.html
https://eurekamag.com/research/006/017/006017436.php?srsltid=AfmBOoowNBPIvOEsbuRTGjcfv-aB8Q8YRsuOqXuc24fc-h126GeCfPrZ
[PDF] telema tenella (simon, 1882) (telemidae) sea-entomologia.org › PDF › RIA_1
[PDF] ROLAND LEGENDRE LA REPRODUCTION PAR ...
www.european-arachnology.org › esa › 2015/08 › 100-103_Legendre En 1977, LOPEZ mettait en évidence la présence d'un spermatophore chez le mâle de Telema tenella (Telemidae) en provenance d'une grotte......