Stridulatoire
Appareil "stridulatoire" des Araignées(Argyrodes en particulier)par André LOPEZ, auteur (version 2025) |
|
Couleurs
conventionnelles :
En noir et italiques termes anatomiques ; en violet,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
orange, parties
les plus importantes
et résumés.
|
|
Abréviations
conventionnelles :
M.E.B. : (photographie en) microscopie électronique à balayage M.E.T. :
(photographie en) microscopie
électronique à transmission
C.H. :
coupe histologique
(microscopie photonique)
|
1- Introduction
2 -Stridulation
3 -Anatomie générale et classification
4 -Observations personnelles
5 -Appareil
stridulatoire d' Holocnemus pluchei
5-1 -La Lyre
5-2 -L'
Archet
6 -Appareil
stridulatoire des Gasteracanthinae
6.1 – Chaetacis
cornuta
6.1.1 - La Lyre
6.1.2 - L'Archet
6.2 -Micrathena
schreibersi
6.2.1 - La Lyre
6.2.2 - L'archet
6.3 - Micrathena clypeata6.3.1 - La Lyre
6.3.2 - L' Archet
7 - Appareil stridulatoire des Argyrodes
7.1 - Aspect au Microscope électronique à balayage.
7.1.1 - La Lyre
7.1.2 - L' Archet
7.2 - Aspect histologique
7.2.1- La Lyre
7.2.2 - L' Archet7.3 - Ultrastructure
7.3.1 - La Lyre
7.3.2 - L'Archet
7.3.2.a - Capteur externe
7.3.2.b - Axe sensoriel
1- Introduction
Il est bien connu que des Myriapodes,
certains Crustacés (Busnel,1963) et
surtout, un
grand nombre d’Insctes appartenant à
des ordres variés (Homoptères, Orthoptères, Lépidoptères comme les
Parnassiinae…)
peuvent émettre des sons.
Divers Arachnides
en produisent aussi mais ce phénomène est généralement insoupçonné car
les vibrations sonores ne sont perceptibles par les Humains que dans de
rares cas. Il est ainsi décrit chez les Scorpions,
les Solifuges (in
Berland,1932) et, en ce qui concerne
plus directement ce site, dans
l’ordre des Aranéides.
La production de sons par les Araignées
a été constatée pour la première
fois il y a plus de 130 ans, lorsque Wood-Mason (1877)
signala
qu’une grande Mygale de l’Inde et Birmanie, Chilobrachys stridulans,
peut être à la source d’un
bruit que l’Homme perçoit à distance.
Il
existe chez les Araignées
trois méthodes pour produire des sons, ou, si l’on préfère, trois types
d’émissions sonores : la vibration
d’appendices,
la percussion du substrat et la stridulation.
La vibration des pattes a été mise en évidence par Rovner (1980) chez la grosse Araignée cosmotropicale Heteropoda venatoria (Eusparassidae) (Fig.galerie). Elle se produirait aussi chez les Ctenidae dont le genre Phoneutria.
Encore
appelée «tambourinage» («drumming» chez
les auteurs anglophones), la percussion du
substrat est réalisée avec les palpes, les pattes et (ou)
l’abdomen. Elle a été découverte par Lahee (1904)
chez des Alopecosa nord-américaines et, par la suite,
observée bien souvent chez d’autres Lycosidae, les
Clubionidae, les Anyphaenidae, les Ctenidae, les Thomisidae et
les Salticidae (revue in Uetz & Stratton,1982).
2 - Stridulation
La stridulation,
ou supposée telle, qui seule nous intéresse ici, existerait dans près
d’une trentaine de familles d’Araignées.
Selon
Busnel (1963), elle peut être définie
chez tous les Arthopodes comme un
moyen de production sonore qui met en jeu le frottement de deux parties
rigides
du corps l’une contre l’autre. Pourvues d’une surface tégumentaire
spéciale, différenciée, ces deux parties constituent l’organe ou appareil
stridulatoire.
Le son
émis chez les Araignées n’est audible sans
amplificateur que dans quelques cas privilégiés. L’oreille
humaine le
perçoit alors de très près (20 cm maximum) chez
certains petits Theridiidae tels
que Steatoda bipunctata (Meyer,1928), à
la distance de 1 m. dans le cas de Micrathena gracilis (Araneidae)(Uetz & Stratton,1982) et
jusqu’à 2 ou 3 ms lorsqu’une Mygale
géante comme Theraphosa
leblondi (Guyane française) se met à striduler (in
Lopez,1988).
On le décrit de manière imagée comme
un
bourdonnement (Sicarius, Micrathena), un
cliquetis
métallique, un sifflement (Mygales),
un grincement ou le bruit obtenu
en
frottant les
dents d’un peigne avec l’ongle ou un couteau. Il peut être même
enregistré et analysé au laboratoire où des sonogrammes et
oscillogrammes ont été obtenus dans divers groupes araneidiens (Uetz
& Stratton,1982).
Les vibrations qui le composent seraient transmises par l’air, par le substrat jouant le role d’une table d’harmonie, et perçues ensuite par les autres Araignées de même espèce, peut être aussi d’espèces différentes, ou par des prédateurs éventuels.
Chez les Araignées,
cette même perception est dévolue à des organes
sensoriels spéciaux, les trichobothries
et les
sensilles à
fentes
(«slit sensilla»)
qui
siègent sur les
pattes.
Barth (1967) l’a démontrée sur lesplans éthologique et
électrophysiologique.
La signification des sons produits est très discutée.
►Valeur sexuelle lorsque la stridulation
n’existe que chez le mâle. Ils pourraient alors faciliter
l’accouplement comme c’est le cas, semble-t-il, chez les Theridiidae Teutana grossa
et Steatoda bipunctata (Gwinner-Hanke,1970).
►Valeur prémonitrice lorsque le son est
émis
par
les deux sexes et semble représenter un moyen d’intimidation. Il
protègerait
l’Araignée contre ses ennemis naturels (Homme compris) en
créant un
effet
de surprise. Une telle fonction semble à peu près certaine dans le cas
particulier
des Mygalomorphes et des Micrathena.
Quoiqu’il en
soit, une stridulation effective n’est que rarement constatée «de auditu ». L’appellation pourtant très suggestive
de certaines
espèces d’Argyrodes
(Theridiidae : A.stridulator, A.ululans ) semble
avoir été inspirée à leurs descripteurs, dont Lawrence (1937), non par
la perception d’un bruit qu’elles auraient
émis, mais par l’observation de
crêtes présumées
stridulatoires («stridulatory
ridges») situées à proximité du pédicule.
Chez la plupart des
Araignées,
l’existence d’une stridulation est
seulement présumée lorsqu’elles possèdent un
appareil
tégumentaire
répondant à la définition générale de Busnel (1963), censé
striduler et que
l’on estime capable
de produire des sons.
3- Anatomie générale et classification
L’appareil
stridulatoire des Araignées,
nom
que nous adoptons ici faute de termes
plus appropriés, est
une
différenciation
spéciale
de leur
tégument, paire,
symétrique et pouvant occuper une position très variée sur
le corps araneidien.
Comme chez les autres Arthropodes,
il comporte toujours deux parties bien distinctes, dites
«antagonistes», visibles à la loupe binoculaire et surtout, au
microscope électronique à balayage (M.E.B.), moyen de recherche
incomparable.
► La «lyre»
ou «rape» («file»
des auteurs de langue anglaise), noms désormais consacrés par l’usage,
est fixe, passive et se présente comme un ensemble de
rides, crêtes
(Fig. ), rugosités diverses ou même,
de
tigelles vibrantes.
► Le «peigne»
ou «racloir» («scraper» des anglo-saxons),
autres termes définitifs, est mobile,
actif et formé
par des dents, des épines, des tubercules chitineux (Fig.
) ou des soies rigides (Fig. ).
► Le peigne
frotte contre la lyre,
ce jeu
mécanique étant responsable soit d’une émission sonore présumée ou avérée,
soit, du
moins chez les Theridiidae Argyrodes, d’une
stimulation nerveuse inédite
et beaucoup plus subtile qui serait
impliquée dans…l’équilibration (Lopez,1988 ;
Lopez,1994a ; Lopez,1994b).
Les deux parties peuvent siéger :
■ sur un même appendice
(surfaces segmentaires opposées d’une articulation
de patte) (Rovner,1975),
■ sur
deux appendices
différents, tels que les pattes
I et II, les deux chélicères,
le bulbe
copulateur et la gnathocoxa,
le pédipalpe
et la chélicère
(Fig.
), le pédipalpe et la patte I, peut être aussi les filières antérieures
chez
certaines Malkaridae (Platnick
& Forster, 1987),
■sur les deux grands tagmes corporels (céphalothorax
ou prosoma et abdomen
ou opisthosoma),
notamment chez les Argyrodes
(Fig. ),
■ sur le pédicule (pédicelle) et l’abdomen,
■ sur un appendice
(patte IV ou postérieure) et l’abdomen
(Fig. ).
Ainsi a-t-on pu définir plusieurs types ou
catégories d’appareils
stridulatoires, en se basant sur les
positions respectives de la lyre
et du peigne
et en créant ainsi au moins 4
classifications :
∙4 types, classés de
« a » à « d » par Berland
(1932),
∙7 types, présentés sans
ordre
défini par Millot (1949),
∙7 types encore, décrits et
énumérés de « a » à « g » par Legendre (1963,1970)
dans son important travail,devenu classique et qui est basé sur
l’examen de 74
espèces appartenant à une quinzaine de familles différentes.
∙8 types
selon Uetz et Stratton (1982)
qui reprennent la classification
deLegendre en lui adjoignant une catégorie particulière
dans laquelle
un seul et même appendice
se trouve concerné (Rovner,1975).
4 - Observations personnelles
L' auteur, A.Lopez, ne présentera ici
que trois types d’appareils
stridulatoires, « a »,
« d »
et « g » dont la découverte et (ou)
l’étude
approfondie chez certaines espèces lui ont permis de contribuer à leur
connaissance.
Dans tous les cas, les examens ont été
réalisés à la loupe binoculaire, en microscopie photonique sur des
coupes colorées par des méthodes histologiques de routine,
et surtout, en microscopie électronique à balayage (M.E.B) (Note ).
Le plus important, celui des Argyrodes (« a »),
dit aussi «prosoma-opisthosoma», sera
d’abord
développé séparément et en détails, ultrastructure comprise
(microscopie électronique à transmission : M.E.T.).
Il sera montré ensuite pour la première
fois que
le type « d »
(chélicères-pédipalpes)
est présent dans le
genre Holocnemus (Pholcidae) et présenté le type "g »
(quatrième
paire de pattes, IV- opisthosoma)
chez quelques Araignées Gastéracanthines de la Guyane
française.
5 - Appareil stridulatoire d' Holocnemus pluchei
L’appareil stridulatoire de type " d " associe une lyre, portée par la chélicère, et un archet, situé sur le pédipalpe ou patte machoire.
Décrit pour la première fois par Simon (1893) chez l’Araignée sud-africaine Sicarius hahni (Sicariidae), il a été retrouvé ensuite chez les Scytodidae(Pickard-Cambridge,1895), les Diguetidae de Californie (Chamberlin, 1924) et, beaucoup plus récemment, chez certains Pholcidae américains du genre Physocyclus (Gertsch, 1979,1982).
L'auteur l'a également observé dans cette dernière
famille (Lopez, 1988) mais il
s’agit en l’occurrence d’ Holocnemus pluchei
(Scop.), un Pholcide
" indigène " très répandu dans nos garrigues
héraultaises (Fig.1) et
jusque dans les
habitations du Bitterois sensu lato, ainsi que leurs
dépendances
(Lopez, 1973a) . Holocnemus
est fort intéressant aussi sur le plan histologique par ses curieuses cellules pigmentaires
étoilées de siège
profond, non épidermique (Lopez,1973b)
enveloppant les glandes épigastriques, s'insinuant entre d'autres
organes (Fig.2) et responsable de la bande noire ventrale
caractéristique, absente chez Pholcus.
 |
 |
| Fig.1 - Holocnemus
pluchei, femelle et sa ponte. Vue latéro-ventrale droite (garrigue du St Chinianais : (© A.Lopez) |
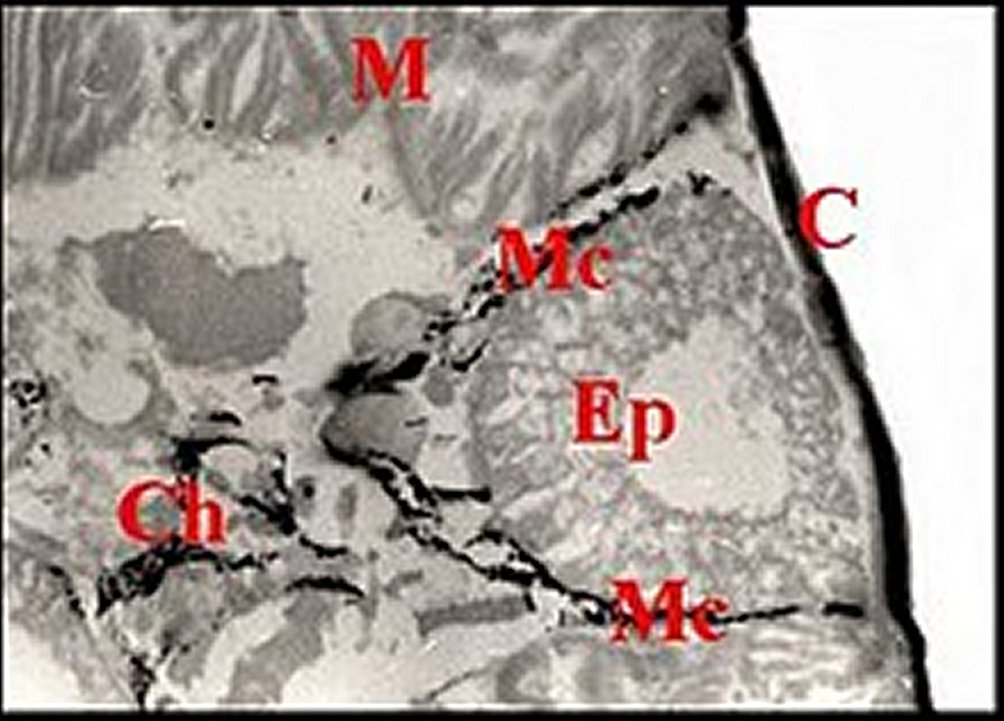
Fig.2
- Holocnemus
pluchei, mâle Coupe histologique de l'abdomen passant par les glandes épigastriques et montrant des chromatophores. |
| Glande épigastrique
prégonoporale (Ep) et son manteau (Mc) de chromatophores se retrouvant
en profondeur (Ch) - C, cuticule ventrale - M, muscles striés (© A.Lopez C.H. )
|
Il faut souligner que sa découverte de
l'appareil stridulatoire
est antérieure de plusieurs années au travail
de Huber (1995) axé sur le comportement sexuel.
Les
exemplaires étudiés, uniquement au M.E.B. (Note), proviennent de
Cessenon (Ouest de l’Hérault, France)(Fig.1) , ainsi d’ailleurs que
de Téboursouk (Tunisie), leur espèce présentant une aire de répartition
circumméditerranéenne très vaste.
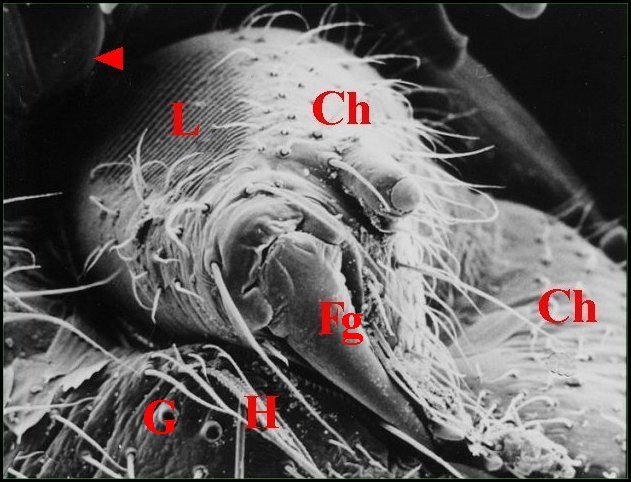
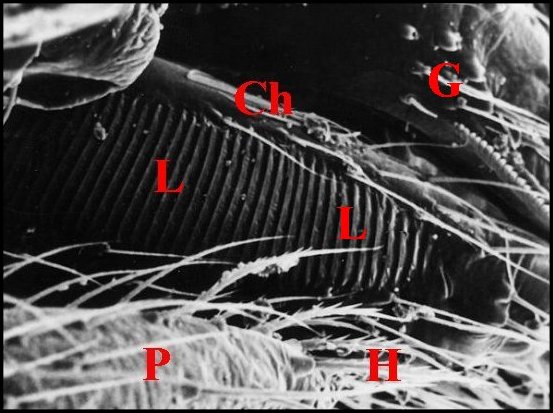
Elle est située sur la face externe de la chélicère, plus précisément sur celle de son article basal, la tige ou paturon. Sous la loupe binoculaire, elle apparaît comme une bande brillante, de couleur rougeâtre, comme striée en travers et disposée verticalement selon le grand axe de la tige chélicérienne.
Au M.E.B., il s’agit d’une zone oblongue, entièrement glabre mais cernée par de nombreux poils, et déprimée en gouttière peu profonde (Fig. ). Elle porte sur toute sa surface une série de 30 à 40 crêtes parallèles, équidistantes, bifurquées parfois à leurs extrémités et séparées par des sillons uniformes qui ont tous la même longueur (Fig. ).
Cette lyre
existe chez toutes les
femelles, où son
aspect ne varie guère (Fig.3 à 5), chez les immatures où elle paraît déjà
bien formée (Fig.7)
et chez les mâles (Fig.6) dont les crêtes
semblent plus
longues, un peu
moins régulières, plus nombreuses
et tendent à s’anastomoser.
 |
 |
 |
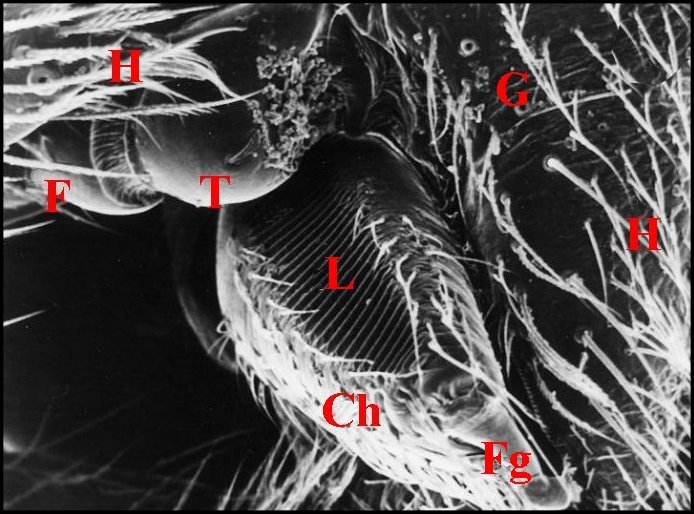
| Fig. 3 - Holocnemus pluchei, femelle : appareil
stridulatoire droit. |
Fig.
4 - Holocnemus
pluchei, autre femelle :
appareil stridulatoire droit. |
Fig. 5 - Holocnemus pluchei, autre femelle
: lyre, détail. |
| Ch, chélicère
(tige ou paturon) - F, fémur - Fg, crochet venimeux -
G, gnathocoxe ou lame maxillaire - H, poils - L, lyre et ses crêtes -
T, trochanter avec petite saillie (Fig.2 : flèche) (© A.Lopez M.E.B. )
|
||
 |
 |
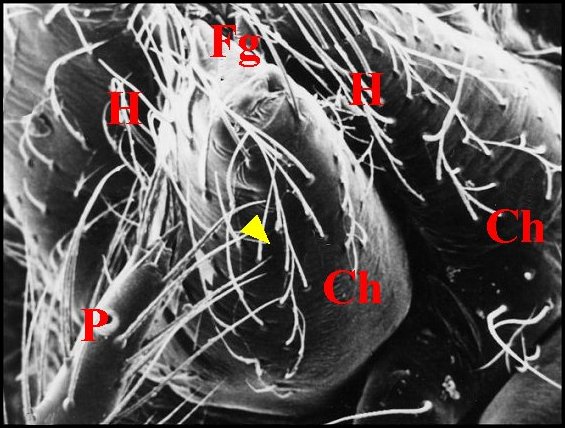 |
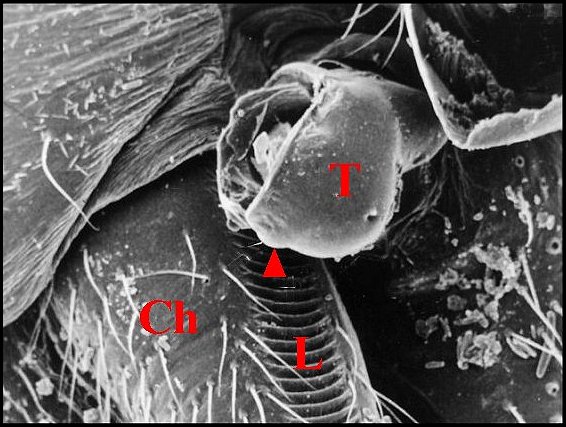
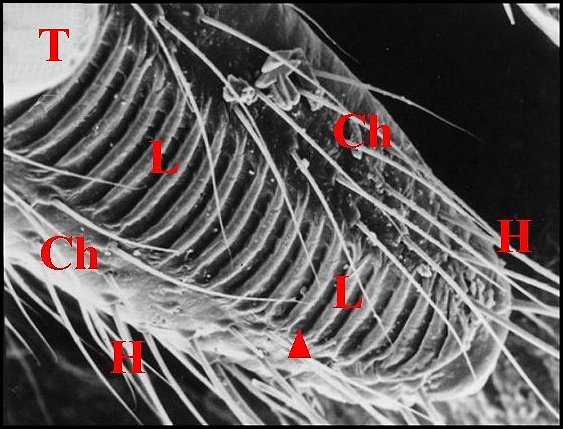
| Fig. 6 - Holocnemus pluchei, mâle :
stridulatoire. |
Fig. 7 - Holocnemus pluchei, immature :
lyre. |
Fig.
8 - Pholcus
phalangioides, femelle : chélicères. |
| Ch, chélicère
(tige ou paturon) - Fg, crochet venimeux - G, gnathocoxe ou
lame maxillaire - H, poils - L, lyre et ses crêtes. Flèche rouge
(Fig.4) : trochanter. Flèche jaune (Fig.6) : emplacement de la lyre,
ici absente
(© A.Lopez M.E.B. )
|
||
6 - Appareil stridulatoire des Gasteracanthinae.
L’appareil stridulatoire du type " g " se compose d’un archet situé sur la 4eme paire de pattes ambulatoires (P IV) et d’une lyre placée sur la face inférieure de l’abdomen. Carpenter (1898) l’a découvert chez Rhaebothorax brocchus et Falconer (1910) l’a retrouvé un peu plus tard en Angleterre chez une autre Erigonide, Eboria caliginosa.
La lyre de ces Araignées est une surface rugueuse correspondant à l’ "opercule", "plaque" ou "couvercle" chitineux du poumon ("booklung cover" des auteurs de langue anglaise). Le peigne qui balaye cette lyre est un relief en forme de dent aiguë siégeant sur le bord interne de la 4eme hanche. Selon Savory (1928), ils n’existeraient que chez le mâle.
En dehors des Erigonidae, seuls cités par Legendre (1963), le type " g " n’a été retrouvé ultérieurement, et jusqu’à la propre étude de l'auteur (Lopez,1988) que chez une Lycoside, Pardosa fulvipes (Col.)(Kronestedt, 1973) et surtout, chez les Gasteracanthinae, sous famille d’Araneidae remarquables par leur "armature" épineuse, leurs couleurs souvent vives et l’aspect original des filières (Fig. )
Hinton et Wilson (1970) précisent que l’archet ("scraper") des Gasteracanthinae est formé par des soies rigides dressées sur la base du fémur de P IV et que leur plaque pulmonaire est couverte de crêtes extrêmement fines et nombreuses ("file"). Leur description est basée sur une étude au M.E.B. concernant les femelles des Micrathena gracilis et schreibersi, espèces américaines. De son côté, Levi (1985) présente une planche photographique montrant les appareils stridulatoires de Chaetacis aureola et Micrathena mitrata, le couvercle du poumon de la première ayant une forme quadrangulaire, celui de la seconde une forme arrondie.
Personnellement, André Lopez a examiné l’appareil
stridulatoire du type " g "
chez des Gasteracanthines
de la Guyane française. Cette sous-famille est représentée dans notre
département néotropical par de nombreuses espèces que les Zoologistes
français, Arachnologues compris, semblent avoir
pratiquement ignoré
jusqu’à sa mise au point (Lopez,1994c.),
laquelle ne figure pas non plus dans Dierkens (2011).
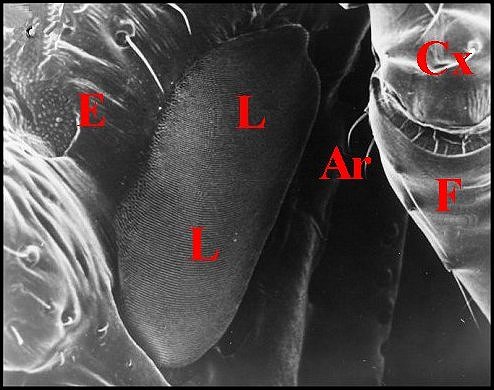
6.1 – Chaetacis cornuta (Taczanowski)
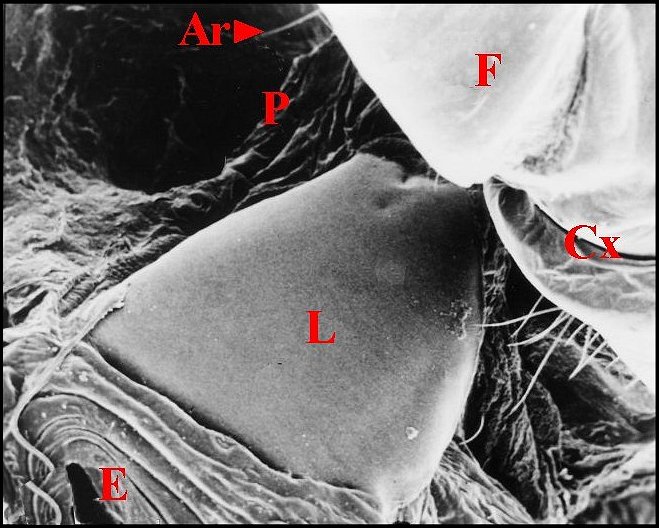
La femelle a des plaques pulmonaires allongées, ovalaires, brunâtres, disposées obliquement par rapport à l’axe longitudinal de l’abdomen (Fig.7). Chacune d’elles mesure environ 0,6 mm de long sur 0,2 mm de largeur maximum.
Il s’agit d’un ennsemble de crêtes nombreuses (environ 150), fines, très serrées, légèrement incurvées et s’anastomosant, à leur extrémité, en un réseau "gaufré" (Fig.8). Cet aspect rappelle celui qu’offre une espèce voisine, Chaetacis aureola (C.L.Koch) au M.E.B. (Levi,1985 : pl.3). Toutefois, sa plaque pulmonaire paraît plus petite et montre un moins grand nombre de crêtes que chez C. cornuta.
 |
 |
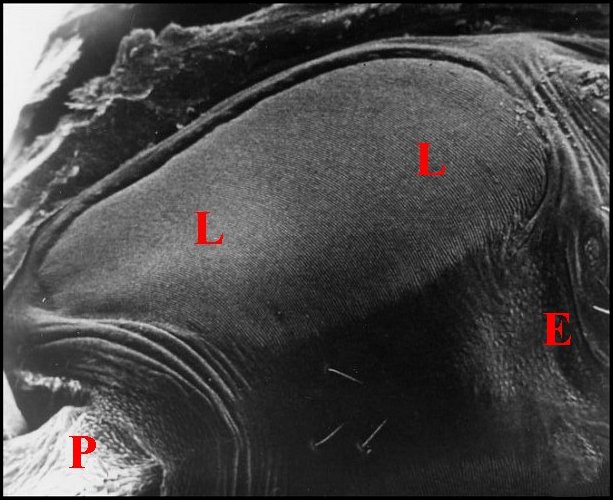 |
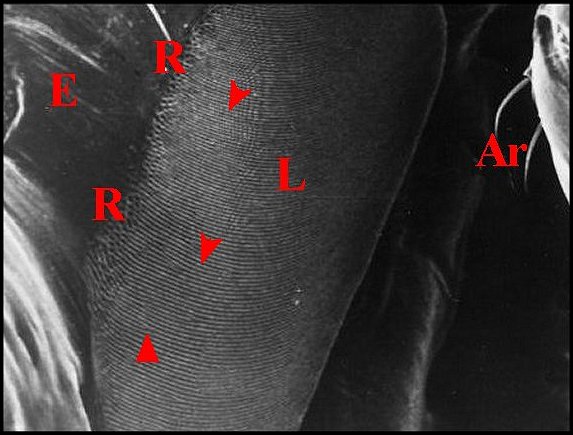
| Fig. 7 - Chaetacis cornuta : stridulatoire
gauche. |
Fig.
8 - Chaetacis
cornuta : lyre gauche, détail . |
Fig.
9- Micrathena scheibersi : lyre
gauche. |
| Ar,
archet
(soies) - Cx, coxa (hanche) - E, partie toute antérieure de la
région épigastrique - F, fémur -
L, lyre - P, pédicule - R, réseau "gaufré". Flèches
: crêtes trés apparentes (© A.Lopez M.E.B. )
|
||
Il est constitué par deux soies courtes, raides, incurvées vers l’arrière et s’implantant sur la base fémorale (Fig.7,8) comme celles que Hinton et Wilson (1970) ont figurées chez des Micrathena. Contrairement à ce qu’a écrit Levi (1985), il ne s’agit donc pas de tubercules coxaux ou fémoraux.
Lopez ne peut fournir de renseignements sur le mâle , qu'il n'a pas récolté.
6.2 – Micrathena schreibersi (Perty)
Cette espèce est la plus éclatante et la plus belle des Gastéracanthines guyanaises (Lopez,1994c).
Bien que
Hinton et Wilson (1970) ne
l’aient pas spécifié, son mâle possède aussi
un appareil
stridulatoire.
 |
| Micrathena schreibersi, femelle, vue dorsale |
| Massif
du Rorota, près de Rémire-Montjoly, Guyane française
(© A.Lopez d'après une diapositive)
|
Elle correspond à la plaque pulmonaire, zone oblongue, d’un noir intense et luisant, arrondie à son extrémité postéro-externe, encochée, près du pédicule à l’antéro-interne (Fig.9), mesurant 0,6 mm dans sa plus grande longueur, 0,3 mm de large, et portant environ 150 crêtes qui sont parfois bifurquées (Fig.10).
Il
est encore formé par des soies fémorales
de sorte que l’appareil stridulatoire rappelle,
en plus petit, celui de la femelle, seule examinée par Hinton et Wilson
(1970).
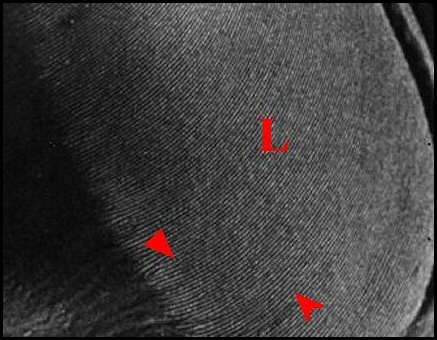 |
 |
 |
| Fig.10- Micrathena scheibersi : lyre gauche,
détail. |
Fig.11
Micrathena clypeata :
stridulatoire
droit. |
Fig.12-
Micrathena clypeata : lyre
droite, détail. |
| Ar, archet
(soies) - Cx, coxa (hanche) - E, région épigastrique -
F, fémur - L, lyre - P, pédicule . Flèches
: crêtes trés apparentes, dédoublées et unies
entre elles. (© A.Lopez M.E.B. )
|
||
6.3 – Micrathena clypeata (Walckenaer).
Cette troisième Gastéracanthine est une curieuse espèce, aplatie, foliacée, beaucoup plus répandue en Guyane (lopez,1994c) que ne semble l’indiquer la citation trop restrictive de Levi, 1985 : Saint Laurent du Maroni.
Elle reste confinée à la plaque pulmonaire, a une forme trapézoïdale (Fig.11) et mesure 0,6 mm de hauteur pour une base de 0,7 mm. Les crêtes y sont extrèmement nombreuses et si rapprochées (environ 3 µ) que je n’ai pu les compter ; elles ne sont pas rectilignes et se dédoublent fréquemment pour s’unir en oblique (Fig.12).
Il est toujours fémoral et constitué par des soies.
7 - Appareil stridulatoire des Argyrodes
L’un des appareils stridulatoires
les plus répandus est le type « a »,
signalé pour la première fois par Westring (1843) sans toutefois le
nommer ainsi, bien défini
par Berland (1932) et surtout par Legendre
(1963). Une «lyre»
céphalothoracique
y
serait raclée par le «peigne» ou, mieux, l'archet
abdominal.
On le connaît
actuellement dans au moins 4 familles : les Theridiidae, les Clubionidae, les Gnaphosidae et les Hahniidae (Uetz et Stratton,1982).
Lopez
l'a particulièrement étudié chez les
Theridiidae du genre
Argyrodes dont
il est l’une des nombreuses caractéristiques conférant à ces petites Araignées
un intérêt majeur. Elles sont en effet remarquables aussi
par leur dimorphisme sexuel
céphalothoracique, en rapport avec l’existence d’une
glande
acronale ou clypéale
n’existant que chez le mâle, par des glandes
à soie originales, par le vif éclat métallique de leur abdomen,
la forme curieuse de leurs cocons et par
le fait qu’elles vivent
généralement en kleptoparasites (inquilins commensaux) sur
la toile d’autres Aranéides.
Un
appareil assez
voisin
pourrait exister aussi dans le genre Asagena.
Au
moins
chez les Argyrodes,
il s’associe aux organes
lyriformes
du pédicelle
(Lopez,1996) constituant
avec ces derniers
un complexe
anatomo-fonctionnel
sus-pédiculaire que nous présumons stato-récepteur (Lopez, 1994a ; Lopez,1994b)
7.1 - Aspect au Microscope électronique à balayage
Le M.E.B. montre sans équivoque l'aspect spectaculaire de l'appareil stridulatoire des Argyrodes, constant et assez homogène malgré des variations (Lopez,1978 ; 1988 ; 1994a ; 1994b ; 1996) (Fig.1 à 5).
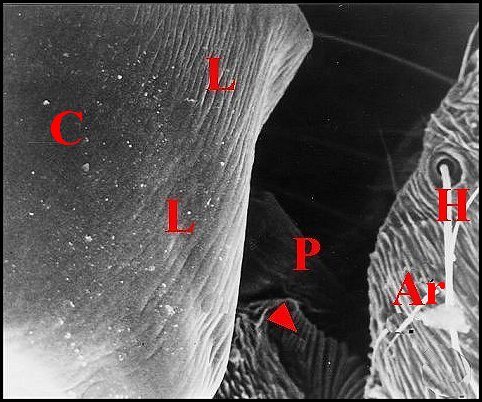
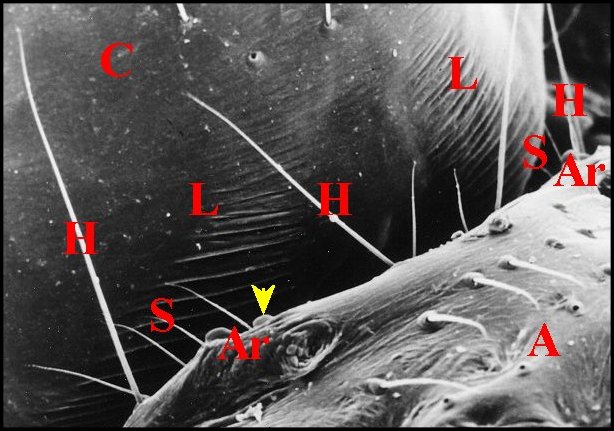
Cet appareil est pair, symétrique et surplombe les parties latéro-dorsales du pédicule où sont visibles les deux organes lyriformes (Fig.13,14Ici comme ailleurs, il comporte bien un archet ("peigne") et une lyre chez toutes les espèces d’Argyrodes étudiées, tant au M.E.B que par l’histologie.
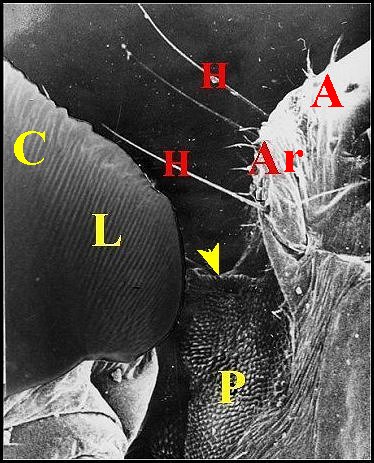 |
| Fig.13
- Argyrodes
argyrodes : appareil stridulatoire, côté gauche.
|
| A,
abdomen - Ar, archet - C,
céphalothorax - H, poils banaux - L, lyre - P, pédicule avec l'organe lyriforme gauche (flèche jaune) (© A.Lopez M.E.B., montage )
|
 |
 |
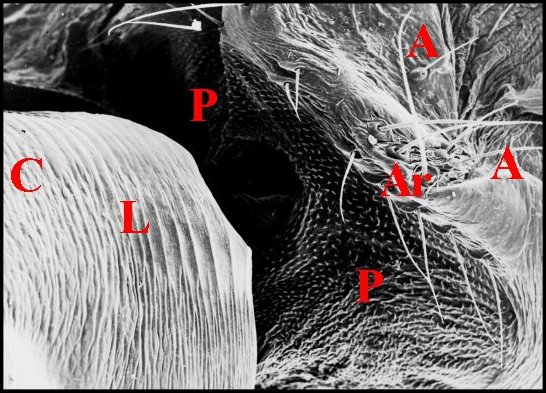 |
| Fig. 14 -
Argyrodes elevatus :
appareil stridulatoire, vue latérale gauche. |
Fig. 15 -
Argyrodes coactatus
: appareil
stridulatoire, vue dorso-latérale gauche. |
Fig.16- Argyrodes fissifrontella
: appareil
stridulatoire, vue dorso-latérale gauche. |
| A, abdomen-Ar, archet - C, céphalothorax-
H, poils banaux - L, lyre - P,
pédicule - S, soies sensorielles. Flèche rouge(Fig.2) : organe
lyriforme gauche. Flèche jaune(Fig.3): l'une des
dents
d'archet. (© A.Lopez M.E.B. ) |
||
7.1.1 - La lyre
Les crêtes peuvent être les seuls reliefs tégumentaires de la lyre ou s'y associent avec de petites tubérosités (Argyrodes ululans : Fig. ).
Elles sont identiques les unes aux autres chez un même individu ou s'accentuent d'avant en arrière et de haut en bas.
Dans le cas particulier du mâle d'Argyrodes dracus (Fig. 17), elles forment deux groupes : l'un antéro-supérieur, qui en comporte une quinzaine, épaisses, trés saillantes, espacées, et l'autre postéro-inférieur où elles sont beaucoup plus nombreuses, fines et trés serrée. Il ne s'agit pas là d'un artéfact car cette bipartition a été observée chez plusieurs individus différents et confirmée par l'étude histologique (Fig...).
Il semblerait que les crêtes des femelles soient généralement moins saillantes et moins régulières que celles des mâles, excepté toutefois chez Argyrodes dracus, où il existe une disposition complexe originale, de gros "plis" alternant avec des groupes de crêtes trés fines (Fig....).
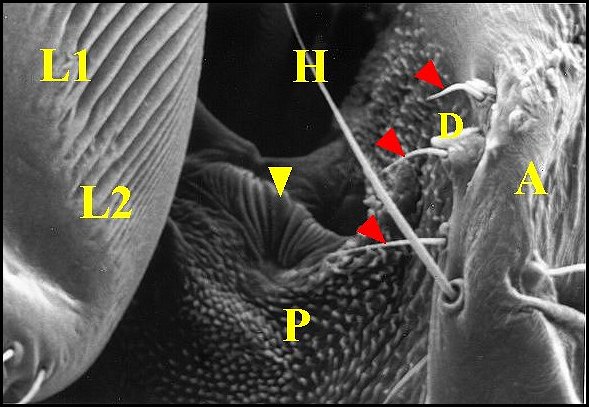 |
| Fig.
17 - Argyrodes
dracus : appareil
stridulatoire, vue latérale gauche. M.E.B. |
| A,
abdomen - D, dent d'archet - H,
poil banal - L1, groupe antérieur des crêtes de la lyre - L2, groupe
postérieur - P, pédicule . Flèche jaune : organe
lyriforme ; flèches rouges
; soies sensorielles de l'archet. |
7.1.2 - L' archet
Il se compose de plusieurs unités indépendantes qui s'échelonnent en
file
oblique et un peu
arquée (Fig.13,16 à 18) ; elles y sont bien
séparées
les unes des autres, excepté dans sa partie supérieure où peut
apparaitre
un couple isolé (Fig.16). Les axes de l'archet et de
la lyre
ne
semblent pas parallèles ; ils délimitent un angle aigu , à sinus
supéro-interne (Fig.15 à 17). Chez A.
argyrodes et A.fissifrontella,
il y a généralement 5 ou 6 unités par archet (fig.13,16)
Nous en avons compté moins chez A. elevatus
et dracus (Fig.14,17).
Ces
unités ont un même
aspect fondamental : elles montrent un poil,
ou soie,
et son alvéole
dont une partie de la margelle forme une dent excentrique (Fig....).
Le
poil est long en moyenne de 50 µm
chez
A.argyrodes (Fig.18,19).
Il s'effile progressivement depuis sa base, où
l'on ne note pas de constriction, jusqu'au sommet, trés
aigu et
dépourvu de pore.
Orientant cette pointe
vers la lyre,
il a une surface lisse et
présente généralement une courbure à concavité postéro-inférieure.
L'alvéole
(largeur totale 15 µm chez
A.argyrodes)
est une cupule plus ou moins profonde et d'orientation
antéro-inféro-externe. Elle montre un fond
"articulaire" et
une margelle plus
ou moins saillante. Cette margelle est
toujours épaissie en ergot dans sa partie supéro-interne où elle
constitue la dent ainsi excentrée : saillie acuminée triangulaire
chez A.argyrodes
(Fig.18,19)
ou A.sp, espèce
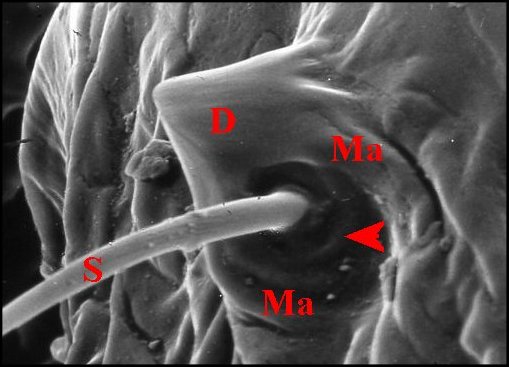
indéterminée (Fig.21), "biseau" oblique d' A.cognatus, relief globuleux d' A.fissifrontella
( Fig. 20). Variable d'une espèce à
l'autre, la dent
l'est aussi chez un même
individu où elle tend parfois à s'émousser du haut en bas de l' archet (A.
cognatus ). Toujours lisse sur son sommet, elle
peut présenter des rides basales (Fig.19) et est dépoourvue de
tout pore
excréteur. Elle a enfin une
orientation constante et se situe toujours au-dessus et en
arrière du poil,
ce qui pourrait refléter
un plan de symétrie bilatérale dans l' organe sous-jacent.
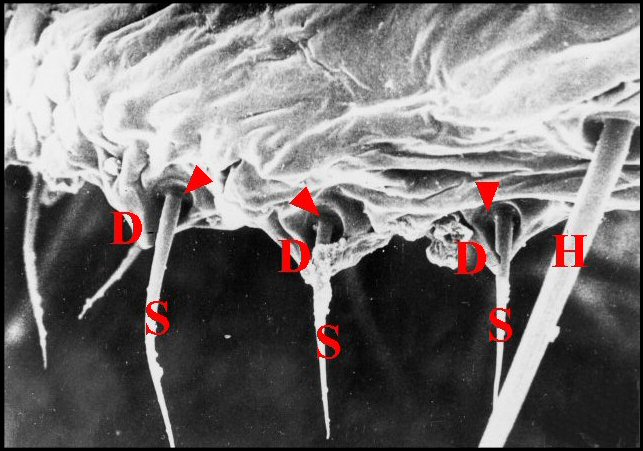 |
 |
| Fig.
18
- Argyrodes argyrodes : archet,
vue
d'ensemble. |
Fig.
19- Argyrodes
argyrodes : 2 unités d'archet, détail. |
| D, dent - H,
poil banal - S, soie ou poil sensoriel. Flèches rouges :
alvéoles (© A.Lopez M.E.B. )
|
|
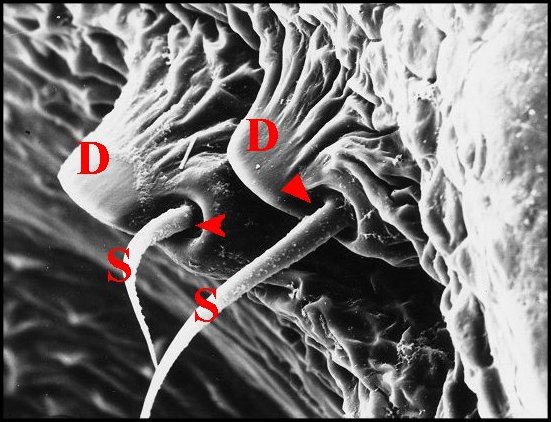
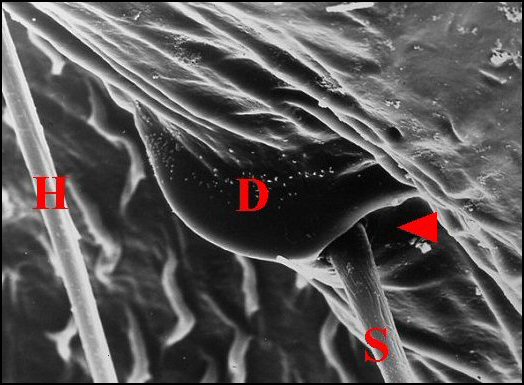 |
 |
| Fig. 20- Argyrodes fissifrontella :
unité d'archet, détail. |
Fig. 21- Argyrodes sp. : unité
d'archet, détail. |
| D, dent - H,
poil banal - Ma, margelle - S, soie ou poil sensoriel. Flèches
rouges :
alvéoles (fond et membrane articulaire
bien visibles dans Fig.21)
(© A.Lopez M.E.B. )
|
|
7.2.1 - La
lyre
Les coupes histologiques
sériées montrent que la lyre
est un
épaississement chitineux d'aspect rigide, formé surtout d'exocuticule.
Sa face profonde est
lisse, régulière et repose sur un épiderme
banal, uniforme, plus ou moins pigmenté, qui ne la pénètre
pas. Cet épithélium entre lui même en
rapport avec un
petit sinus
hémolymphatique et des fibres musculaires striées.
La face
superficielle est en
revanche régulièrement
crénelée par la série des crêtes et ne
présente aucune solution de continuité, la cuticule
étant ininterrompue dans toute la lyre
(Fig.22 à 24).
Cette dernière est donc
bien un simple épaississement cuticulaire périodique, sans
participation de
l'épiderme sous-jacent.
 |
 |
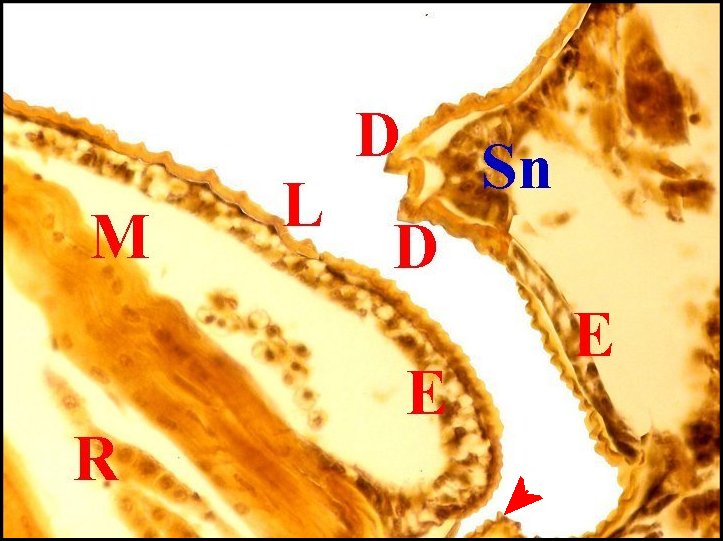 |
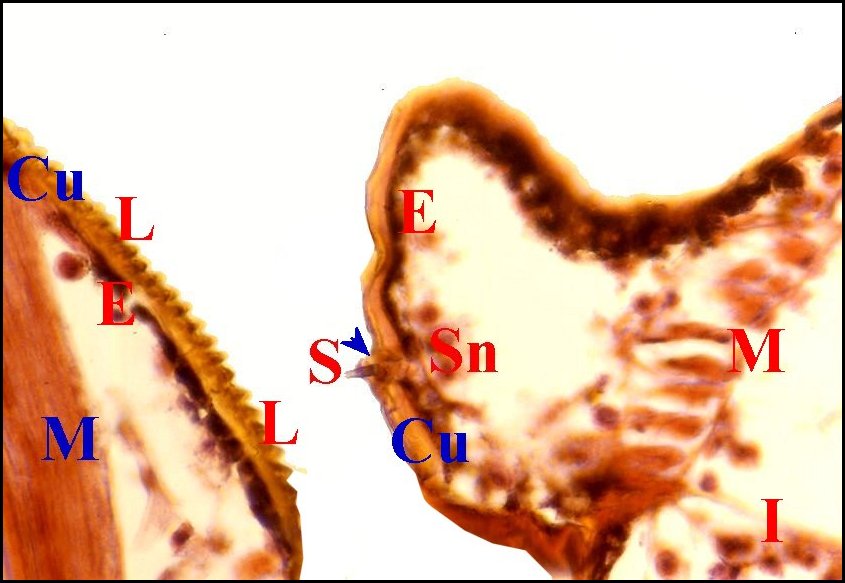
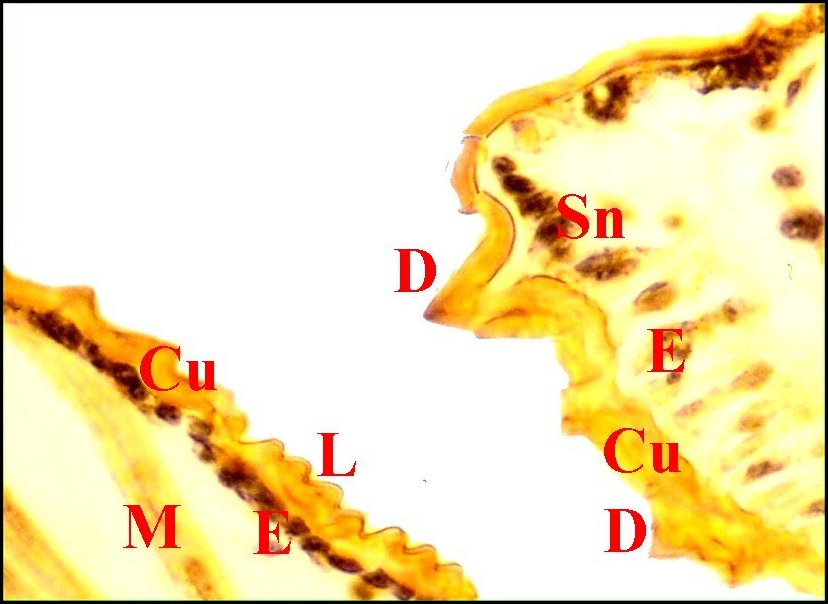
| Fig. 22 -
Argyrodes argyrodes
: appareil stridulatoire. |
Fig.
23 - Argyrodes
caudatus: appareil stridulatoire. |
Fig.
24- Argyrodes
fissifrontella : appareil
stridulatoire. |
|
Cu, cuticule -
D, dent d'archet - E, épiderme - I, diverticule intestinal - L,
lyre et ses crêtes - M, muscle strié - R, tissu réticulé
du prosoma - S, poil sensoriel - Sn, axe sensoriel. Flèche bleue
(Fig.22) : dent apparaissant derrière le poil. Flèche rouge (Fig.24)
: pédicule.
(© A.Lopez C.H.)
|
7.2.2 - L'archet
Il est formé par un
ensemble d'unités
plus ou moins espacées
Au niveau de chacune d'elles,
la cuticule
est non seulement épaissie en bloc mais forme aussi à sa surface chaque
dent observée
au M.E.B. Cette saillie est
plus ou moins effilée et régulière ; elle flanque le poil ou soie,
qui s'y superpose dans une même coupe histologique (Fig.22)
ou
est retrouvé, plus
dégagé
et donc plus apparent, dans la section voisine.
L'épiderme
sous-jacent est plus ou moins chargé de mélanine
et présente un aspect banal entre les unités
de l'archet.
Au niveau de chacune d'elles,
il
se différencie en un petit massif cunéiforme s'engageant dans la cuticule jusqu'à l'alvéole
du poil (Fig.22,24).
Dans ce massif, qui correspond à l'axe
sensoriel
de la M.E.T, on peut discerner une cavité mal définie, deux cellules nerveuses
à gros noyau
nettement nucléolé et cytoplasme clair,
leurs
prolongements
qui s'effilent vers la
dent et
le poil, ainsi que des cellules "satellites" plus petites et plus chromatiques (Fig.24). Leur ensemble
entre en rapport avec des hémocytes, des fibres
musculaires striées et
les diverticules
intestinaux de la partie
antéro-supérieure de l'abdomen
(Fig.22).
7.3 - Ultrastructure
Alors que la lyre
est continue, l'archet
se compose de plusieurs unités
bien
distinctes qui
sont
indiscutablement sensorielles. Des sensilles
cuticulaires d'ultrastructure
trés voisine
se
juxtaposent en
revanche dans le pédicule adjacent pour y
former un organe
lyriforme unique.
7.3.1 - La lyre
Elle comporte vers
l'extérieur une épicuticule régulièrement ondulée,
mince
(0,4 nm) et présentant
deux couches : l'une
externe, trés dense aux électrons ; l'autre
interne, moins dense, moins homogène et d'épaisseur plus réduite.
A
leur zone de contact, ces couches forment de fines denticulations qui
s'interpénètrent et les engrènent étroitement l'une dans l'autre.
L'endocuticule
est épaisse d'environ 10 nm et
suit les ondulations de l'épicuticule,
atténuées toutefois sur sa face interne. Elle présente des canaux poraires
étroits dans lesquels l'épiderme sous-jacent,
uniformément plat, ne
s'engage pas.
7.3.2- L'archet
Toutes les
unités qui le constituent possèdent
une même
ultrastructure
confirmant son aspect histologique d'organe nerveux et évoquant
d'emblée des sensilles mécanoréceptrices du
type I défini et
décrit par
Mc Iver (1975)
chez les Arthropodes.
Chacune d'elles
comporte un capteur
externe cuticulaire et
un axe
sensoriel. Ce dernier est formé par 2 neurones
bipolaires et par 3 cellules enveloppes
entourant les dendrites.
Il est formé par le poil, son alvéole et l’excroissance en dent qu’elle porte.
Le poil est lisse, de section circulaire et creusé d’un canal. Ce dernier ne renferme pas de prolongements nerveux et ne communique pas avec l’extérieur. Sa paroi est épaisse, formée par de l’épicuticule et surtout , par de l’exocuticule se poursuivant, à la base, dans la membrane articulaire qui constitue le fond de l’alvéole.
La dent est un épaississement considérable de la margelle dans sa partie antérieure, entièrement chitineux, ayant la forme d’un cône grossier, haut d’environ 10 µm et dépourvu de cavité. Son endocuticule lamellaire émet un apodème, expansion profonde dont l’aspect évoque un " levier " vertical, légèrement incurvé (Fig.23, 27,28). Cet apodème fait saillie dans une cavité qui excave la cuticule sous la membrane alvéolaire, entre la base de la dent et la zone d’implantation du poil, très excentrée.
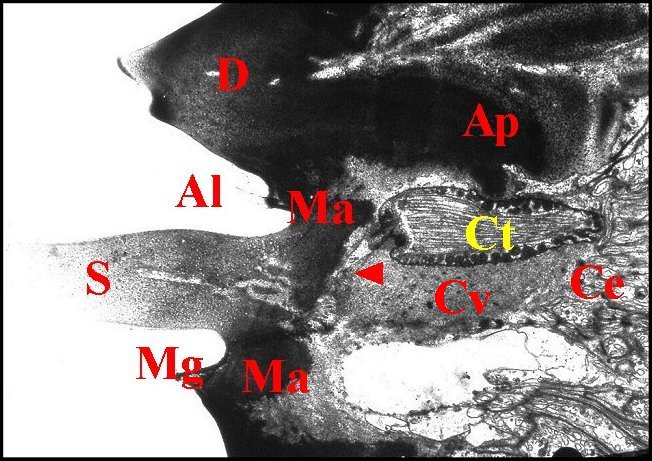 |
| Fig.
25 - Argyrodes
argyrodes : capteur et
partie de l' axe
sensoriel.
M.E.T. |
| Al,
alvéole - Ap, apodème - Ce,
cellules enveloppes (partie) - D, dent d'archet - Ct, corps
tubulaire ; Cv, cavité sous-cuticulaire
; D, dent d'archet ;
Ma, membrane articulaire ; Mg, margelle ; S, soie sensorielle.
Flèche
: gaine scolopale (© A.Lopez M.E.B. )
|
Comme l’histologie permettait de l’envisager, il est bien constitué par deux neurones. Bipolaire, chacun d'eux montre un axone, un corps cellulaire et un dendrite se terminant par un cil.
► Axone
Il est
riche
en mitochondries et neurotubules
mais ne peut être observé
sur un long trajet. Avec son
homologue, il rejoint peut être le nerf du
pédicule (nerf segmentaire
I de Legendre, 1958).
► Corps cellulaire
Il est ovoïde,
assez volumineux et mesure approximativement 15 µm dans son grand axe,
10 dans le petit.
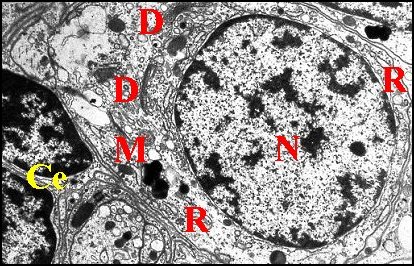 |
| Fig.
26 - Argyrodes
argyrodes : corps d'un neurone et cellules
enveloppes. M.E.T. |
| Ce,
cellules enveloppes et leurs
noyaux ; D, dictyosomes ; M, mitochondries ; N, noyau du neurone ; R,
réticulum
(© A.Lopez M.E.B. )
|
Le noyau est plus ou moins arrondi, régulier et à chromatine peu dense, répartie en mottes, les plus petites s’accolant à l’enveloppe nucléaire. Le cytoplasme renferme du réticulum endoplasmique granulaire formant des saccules plus ou moins enroulés, des dictyosomes et de nombreuses mitochondries (Fig.26).
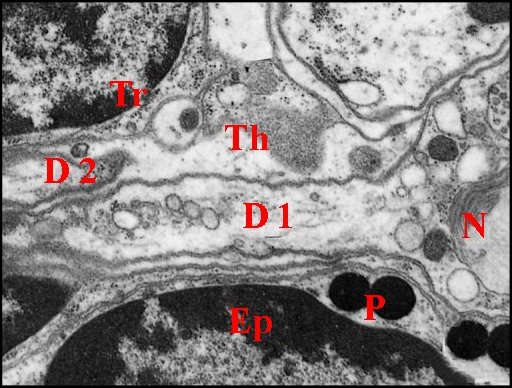 |
 |
| Fig. 27 - Argyrodes argyrodes , axe sensoriel : neurone, dendrites, enveloppes |
Fig. 28 - Argyrodes argyrodes , axe sensoriel : cils (en oblique), enveloppes |
| Cl 1, Cl
2, cils ; Ct, corps tubulaire (partie) D1, D2, dendrites ; Ep, noyau de
cellule épidermique ; Mv, microvilli ; N, neurone (corps) ; P, pigment
; Th, cellule thécogène ; Tr, cellule trichogène. Flèches : gaine
scolopale. |
|
►Dendrites
Deux dendrites, un pour chaque neurone,
pénètrent latéralement dans la cellule thécogène,
d’abord séparés puis contigus (Fig.27). Leur segment interne (diamètre moyen : 1 µm)
renferme des neurotubules, de nombreuses mitochondries, des ribosomes,
des corps
mlultivésiculaires et du glycogène. Chacun d’eux donne naissance à un cil à la base duquel se trouve un seul centriole d’où partent des racines ciliaires très courtes. Les microtubules y sont répartis en 9 doublets périphériques. Les cils (Fig.28,29) ont d’abord le
même diamètre à leur base (0,4 µm). L’un d’eux devient ensuite plus
gros que l’autre puis s’élargit brusquement à son extrémité distale où
se différencie un corps tubulaire
volumineux (Fig.25,
30 à 32 ). Ce dernier, long d’environ 15 µm pour
un
diamètre de 5, renferme de nombreux microtubules
associés à un matériel peu
osmiophile les unissant entre eux et
à la membrane du cil.
Il
pénètre dans la cavité
sous-cuticulaire,
y entre
latéralement en contact étroit avec l’apodème
(Fig.25,30,31) et gagne la base du poil
dans sa partie la plus proche de la dent
chitineuse.L’autre cil diminue
progressivement de diamètre et disparaît au niveau de la base du corps tubulaire.Libres à leur origine sur un
trajet très court (1 à 2 µm), les deux cils sont
ensuite enfermés dans une gaine cuticulaire
ou scolopale. Elle les enserre d’abord
étroitement, au niveau des cellules thécogène
et trichogène (partie inférieure), puis
forme une cavité spacieuse, remarquable par
les sinuosités de ses contours, jusqu’à la base du corps tubulaire . Au niveau de ce dernier, elle
se rapproche de la membrane du cil et
n’en est plus séparée que par une
couche
de gros granules. Ils mesurent 150 à 200
nm de diamètre et selon l’incidence des coupes, paraissent libres ou
unis
par un pédicule à la face interne de la gaine
qui paraît alors les bourgeonner. Ils sont hétérogènes, montrent un
cortex
à deux couches, l’une dense, l’autre claire, ainsi qu’une zone centrale
d’aspect
réticulé (Fig.32) et refoulent la membrane
du cil sans qu’elle se plaque outefois
sur
les microtubules
sous-jacents. Au delà
du
corps tubulaire, la gaine
ne contient plus de prolongement nerveux mais
s'infléchit, s'étire en cône et va finalement s'insérer sur la
base du
poil en s'y confondant.
 |
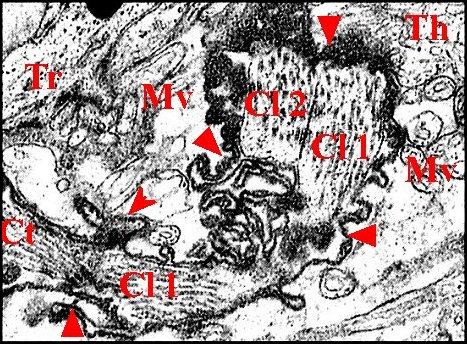
 |
|
Fig. 29 - Argyrodes
argyrodes , axe sensoriel :
cils (en travers), enveloppes
|
Fig. 30 - Argyrodes argyrodes : capteur (apodème)
et corps tubulaire. M.E.T. |
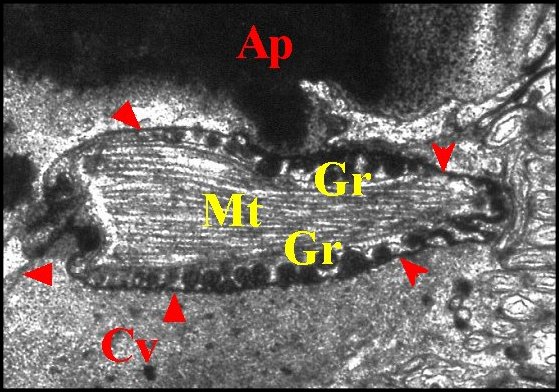
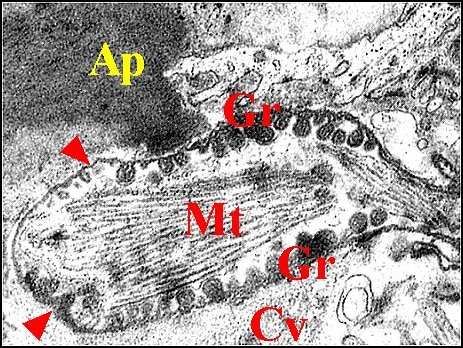
| Ap,
apodème ; Ci 1, Ci 2, cils ; Cv, cavité sous-cuticulaire ; Gr,
grains ; Mv,
microvilli ; Mt, microtubules. P, pigment épidermique
; Th, cellule thécogène ; Tr, cellule trichogène.
Flèches : gaine scolopale |
|
 |
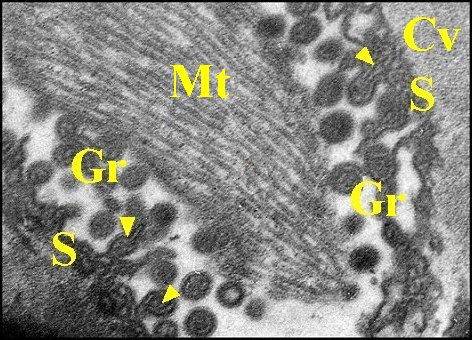 |
| Fig. 31- Argyrodes argyrodes : autre vue. M.E.T. |
Fig. 32- Argyrodes argyrodes : autre vue. Corps tubulaire, détail. M.E.T. |
| Ap, apodème ;
Cv, cavité sous-cuticulaire ; Gr, grains ; Mt, microtubules ; S
(Fig.29) et flèches rouges (Fig.28), gaine scolopale.
Flèches jaunes (Fig.29) : partie centrale réticulée des grains. |
|
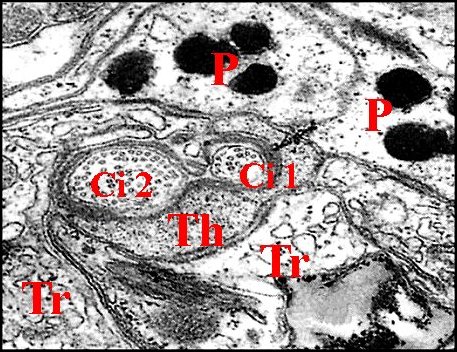
►Cellules enveloppes
Etoitement
accolées, elles sont au nombre de 3 par unité
d’archet : cellules thécogène,
la plus interne, trichogène et tormogène, la plus externe.Elles sont garnies
de microvilli apicales en bordure des cavités extracellulaires (Fig.28,30
)
La cellule
thécogène est trés allongée et
entoure les dendrites dès leur apparition. Son noyau est basal, ovoïde et riche en chromatine formant de grosses mottes denses.
Trés riche en
ribosomes libres, son cytoplasme renferme des dictyosomes
et de fins granules probablement à
l'origine de la gaine
scolopale.
Cette dernière se
matérialise dans la cavité extracellulaire où
est également visible un matériel subhomogène, dense aux électrons.
La cellule
trichogène se referme sur elle
même par un méso
en formant un manchon. Sa partie inférieure enserre étroitement la cellule thécogène, tandis que sa partie
supérieure présente une cavité
extracellulaire que bordent
quelques microvillosités.
Le noyau est basal, trés allongé et riche
en chromatine. Moyennement dense aux
électrons, le cytoplasme renferme de
nombreuses mitochondries, des
grains de
sécrétion, de nombreuses
vésicules
de réticulum
lisse et des vacuoles à contours irréguliers avec des parois
plus ou moins densifiées et un contenu amorphe.
Volumineuse et aplatie, la cellule tormogène fait suite à la précédente.
Sa cavité
extracellulaire est trés
spacieuse, emplie d'une substance finement grenue, en continuité avec
la sous-cuticulaire, prolonge celle de la
cellule
trichogène et est bordée par de
nombreuses microvilli
(Fig.28,30).Ces
dernières sont nombreuses, irrégulières et prennent souvent l'aspect de
lamelles émettant des prolongements anastomosés. Le noyau est latéral, aplati, riche en chromatine. Le cytoplasme
contient un grand nombre de mitochondries
et de vacuoles.
8 - Commentaires
8.1 - Sur le plan anatomique, l’ appareil stridulatoire d’Holocnemes pluchei correspond au soustype " d II " (" organe de Simon ") individualisé par Legendre (1963) Présent dans les deux sexes, il diffère donc de celui des Pholcidae américains Physocyclus, propre aux mâles et dont l’archet est un " éperon " aigu siégeant sur la base du fémur pédipalpaire (Gertsch,1982).
En ce qui
concerne les Gasteracanthinae les appareils étudiés se rattachent
bien au type
" g ". Comme Hinton et Wilson (1970) l’ont suggéré
à propos des Micrathena schreibersi
et gracilis, il existe bien
des différences intergénériques et interspécifiques dans la
microsculpture de la polaque pulmonaire. Mais outre
l’espacement des crêtes, elles semblent
intéresser aussi leur structure même
ce que devrait confirmer une révision exhaustive.
Chez les Argyrodes, la lyre est une simple différenciation cuticulaire prosomatique, d’aspect passif et inerte, non associée avec des cellules nerveuses. L’archet en revanche est un ensemble de sensilles, chacune de ces unités, toutes semblables, appartenant au sous-groupe des mécanorécepteurs cuticulaires dans le type I de Mc Iver (1975). Le corps tubulaire en est éminemment caractéristique comme chez tous les autres Arthropodes.
Ces mécanorécepteurs sont "purs", l’ultrastructure de leur poil, dépourvu de tout pore apical ou autre ouverture externe, et de terminaison nerveuse intra-luminale, permettant d’éliminer une composante chémoréceptrice comme celle décrite par exemple dans les sensilles appendiculaires de Ciniflo (Dictynidae : Harris & Mill, 1973). Ils peuvent donc être toujours unique (rapprochés de ceux, également " purs ", décrits dans les tarses d’autres Araignées (genre Araneus : Chu-Wang & Foelix, 1973) et retrouvés plus tard dans tous les poils tactiles. Leurs corps tubulaires ont une ultrastructure spéciale très voisine. Tous renferment en effet de curieux granules logés entre la gaine scolopale et la membrane dendritique. Observés chez des Araignées de familles différentes (Ctenidae, Dictynidae)(Barth,1971 ; Harris & Mill, 1977?), ainsi d’ailleurs que chez les Scorpions et les Tiques (Acariens), ces granules pourraient dériver de la cuticule, d' où leur autre nom de "globules cuticulaires".
L’innervation de chaque unité d’archet est multiple, comme dans tous les mécanorécepteurs d’ Arachnides, et la distingue donc des sensilles mécanorécepteurs d’ Insectes à neurone......elle est également double, ce qui l’oppose aussi aux poils tactiles banaux d’ Araignées toujours pourvus de 3 neurones que leurs terminaisons dendritiques rattachent à la base pilaire (Chu-Wang & Foelix, 1973 ; Harris & Mill, 1977), ainsi qu’aux trichobothries qui peuvent en posséder (Christian,1971). toujours unique (Mac Iver,1975). Mais
Cette double innervation de l’unité d’archet
rappelle en revanche
celle des lyrifissures, isolées ou réunies en organes lyriformes,
sur
les appendices de Cupiennius (Barth,1971) et
surtout, en ce qui nous concerne ici,
sur le pédicule des Argyrodes où des organes lyriformes en
" bourrelet " (Lopez,1996) s’associent
aux appareils "stridulatoires" pour former
un " complexe " au moins anatomique.
Les
rapports étroits entre le corps tubulaire
et l’ apodème
du bord de l’alvéole rappellent ceux qui
ont
été signalés par Hawke et al. (1973) dans l’ ovipositeur
d’un InsecteHyménoptère, Orgilus lepidus. Une
formation
évoquant la structure en "levier" qu’émet l’apodème
d’ Argyrodes
a été décrite
par
Gaffal et Hansen (1972) dans les sensilles
antennaires d'un Insecte, l’Hémiptère
Dysdercus intermedius. Elle se détache toutefois du poil lui-même et en transmet vraisemblablement
au
dendrite la pression mécanique.
8.2 - Sur le plan fonctionnel, les deux appareils stridulatoires " d " et " g " ne peuvent intervenir dans l’équilibration.
8.2.1 - Lorsque celui d’Holocnemus pluchei entre en activité, son composant trochantérien doit être animé d’un mouvement oscillatoire, uni ou bilatéral, qui lui fait frotter les crêtes de la lyre. Les vibrations émises chez le Pholcide sont vraisemblablement impliquées dans la reconnaissance intra-spécifique. Ce rôle paraît beaucoup plus plausible qu’une fonction d’avertissement, donc de défense, vis à vis des agresseurs éventuels, et surtout, d’une attaction sexuelle car l’appareil est présent chez le mâle, la femelle ainsi que les immatures.
8.2.2
- Le frottement des
soies fémorales de Gastéracanthines contre les crêtes pulmonaires est
générateur de vibrations. Amplifiées par
le poumon
jouant ainsi un rôle de caisse de
résonance, elles ont pu être enregistrées en laboratoire (Hinton
& Wilson,1970 ; Uetz
& Stratton, 1982), sont perçues aussi
au toucher lorsqu’on saisit une Micrathena
avec
les doigts et peuvent être audibles comme un bourdonnement, lorsqu’on
l’importune sur sa toile. Ce bruit (" low-pitched buzz ")
serait
perceptible jusqu’à 1 m de Micrathena
gracilis (Hinton &
Wilson,1970 ; Uetz
&
Stratton, 1982). Levi (1985) n’a pu
toutefois confirmer son émission
chez plusieurs autres espèces.
Quoi qu’il en soit, l’appareil
stridulatoire des Gastéracanthines n’a pas
de fonction sexuelle pour
les précédents auteurs, mais représente, par ses vibrations,
un système
défensif :
►Effet de " surprise "
temporaire que l’ Araignée met
à profit pour s’enfuir, se comportant ainsi comme certains Insectes
stridulants (Masters, 1979)
►Imitation, par la fréquence sonore,
des battements
alaires de certaines Guêpes chasseresses (ici Pompilides) que redoutent les
autres Arthropodes,
cette sorte de "mimétisme vibratoire" protégeant
ainsi l’ Araignée.
►Diffraction d’une
lumière rasante par les lyres pulmonaires,
du moins dans le cas de Micrathena
schreibersi (Hinton
&
Wilson, 1970), le spectre émis jouant un rôle
de couleurs d’avertissement comme dans le cas de l’appareil
stridulatoire abdominal des Mutillidae
(Insectes
Hyménoptères) (Hinton, Gibbs & Silberglied, 1969).
Complémentaires ou pas dela stridulation, ces couleurs d’avertissement
"intimideraient" l’adversaire des Micrathena
en renforçant l’effet aposématique de leur livrée
abdominale brillante.
8.2.3
- L’appareil
stridulatoire " a " des Argyrodes est, sans aucun doute,
impliqué dans l'équilibration.
Comme chez certains Insectes,
l’apodème de
l’unité d’archet
et son "levier"
pourraient transmettre au corps tubulaire
d’
Argyrodes les vibrations ou
déplacements
de la dent, et la gaine
dendritique, les mouvements et l’incurvation plus ou
moins
marquée
du poil sous
la poussée de la lyre.
Il est vraisemblable que la transduction du stimulus mécanique en
potentiel
de récepteur se produit au niveau du corps
tubulaire
comme dans les autres sensilles d’Arthropodes (Mc Iver,1975). Ce corps
serait
comprimé (Thurm,1964) ou subirait une
incurvation tendant la membrane
dendritique
contre le cytosquelette des
microtubules. Il en résulterait une
dépolarisation
(Rice & al.,1973).
Quant aux granules
ou
globules cuticulaires, ils
jouent peut-être un rôle de "couplage" ou d’
"accrochage"
(Christian,1971 : "clamping device")
Les cellules
enveloppes doivent sécrèter
le liquide qui
emplit les espaces
extracellulaires ("inner and outer
receptor
lymph cavities ") et y assure pour les dendrites
une fonction nutritive ou facilitant leurs activités électriques. De
plus,
l’une d’elles, la cellule thécogène,
est
productrice
de la gaine scolopale.
En ce qui concerne la fonction réelle de l’appareil dit "stridulatoire", une émission sonore paraît très peu probable chez les Argyrodes. Bien qu’ elle soit suggérée par les noms des deux espèces Argyrodes ululans et stridulator, on ne l'a jamais démontrée dans ce genre exceptionnel. Sa biologie est aujourd’hui bien connue sous l’angle des mœurs sexuelles liées en partie à la glande acronale (ex "clypéale"), kleptoparasitaires et prédatrices, au cours desquelles une intervention sonore, audible ou du moins enregistrable, n’a jamais été constatée pas plus d’ailleurs que dans la grande majorité des autres appareils. Il s’ensuit que la prédiction de Legendre (1963) les créditant d’un " rôle beaucoup plus important que celui que nous tentons de (leur) attribuer " est aujourd’hui confirmée.
Une
comparaison de la lyre et de l’archet des
Argyrodes avec certains champs sensoriels particuliers existant chez
les Insectes permet d’en fournir une interprétation fonctionnelle.
Par
leur structure et surtout leur situation
dans les deux parties du corps (tagmes :
céphalothorax et abdomen)
indépendantes, bien que très voisines, et surtout, mobiles l'une par
rapport à l'autre lors des déplacements de l' Araignée, la lyre et l’archet
peuvent être rapprochés de certains "champs
de
soies" existant chez les Hyménoptères sociaux.
Parmi ces plages
sensorielles pilifères
décrites en détail chez l ‘Abeille, celle
dite de
"l’articulation du pétiole" (Lindauer & Nedel, 1959 ; Markl,
1968)
rappelle tout particulièrement le prétendu appareil
stridulatoire d’ Argyrodes.
Il
s’agit de deux champs de soies,
pairs et
symétriques,
situés sur le deuxième segment abdominal
et que des prolongements et replis thoraco-abdominaux
"antagonistes ",
les " butoirs " (Schéma), viennent heurter et tendent à
courber plus
ou moins lorsque l’Abeille se déplace.
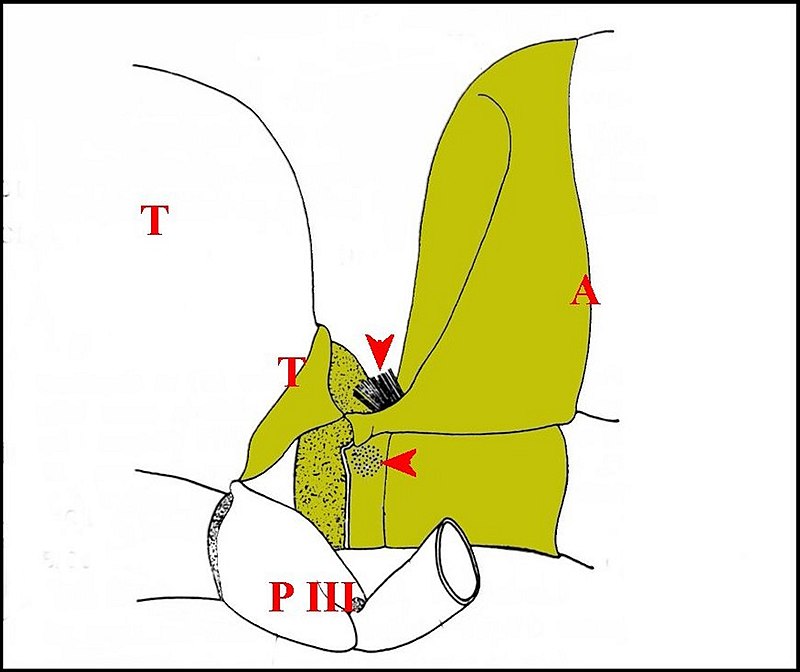 |
| Apis mellifica
: région du pétiole et champs de soies |
| A, abdomen - P III, patte arrière - T, thorax - flèches : champs de soies (d'après Markl) |
Les sensillae
trichodea de ces soies, innervées
aussi par des cellules
bipolaires, ont
une ultrastructure (Thurm,1964) rappelant
celle de chaque unité d’archet
d’ Argyrodes,
si toutefois l’on excepte leur innervation unique, et sont
indiscutablement sensibles à la pesanteur comme l’ont montré diverses
recherches expérimentales (in Markl., 1968).
Par rapport à l’ensemble
du corps, elles percevraient l’emplacement de parties toutes entières,
mobiles suivant la gravité, et permettraient par voie réflexe, un
contrôle musculaire de la position des axes corporels les uns par
rapport aux autres.
L’existence de
tels mécanorécepteurs
paraît conditionnée
par celle d’un abdomen
volumineux,
susceptible de déséquilibrer l’animal à tout instant : "gastre"
des Abeilles et Fourmis,
abdomen ou opisthosoma des
Argyrodes.
Ce dernier, que pare
souvent un vif éclat métallique (guaninocytes
intestinaux), est en effet remarquablement volumineux et
disproportionné par rapport au reste du corps,
plus ou moins élevé, conique, pesant et doit donc être sollicité sans
cesse par les forces de gravité. ..
De ce fait, la petite Araignée est exposée à une distorsion du pédicule menaçant les organes fragiles qui le traversent lorsque son abdomen vient à s’incliner latéralement ou bascule contre le céphalothorax. A l’instar des Hyménoptères sociaux, où les sensilles abdominales sont excitées par le thorax, on peut admettre chez Argyrodes que la stimulation des sensilles d’archet (opisthosoma) par la lyre (prosoma) entraine des contractions musculaires suivant un arc réflexe et rétablit ainsi son équilibre : l’opisthosoma oriente en l’air sa face ventrale dans une position de "confort " optimum.
Cette stimulation pourrait être uni ou bilatérale, d’intensité plus ou moins grande suivant le degré d’incurvation des poils et le nombre des sensilles affectées, que la dent joue un simple rôle de butée, limitant la course du poil dans un plan donné, ou qu’elle heurte aussi les stries de la lyre. Dans ce cas, le maintien à un niveau constant du degré d’excitation de l’appareil par le jeu équilibré des poils et des dents deviendrait coincevable comme chez les Insectes Hyménoptères (Markl, 1968).
L'ultrastructure de l’appareil "stridulatoire" des Argyrodes et sa comparaison avec les champs sensoriels articulaires d’Insectes plaident donc en faveur d’un rôle dans la statoréception.
Il est possible que du moins chez Argyrodes, le complexe pédiculaire formé avec les organes lyriformes en "bourrelet" ne se réduise pas à de simples rapports anatomiques de voisinage mais soit une véritable association fonctionnelle entre récepteurs de gravité. Coordonnant leur activité suivant un processus qui nous échappe encore, ils permettraient à l’Araignée d’orienter dans l’espace les deux tagmes de son corps, sans préjudice pour le pédicule fragile et en fonction de sa position de repos habituelle.
Un tel concept du type " a " sera peut être étendu ultérieurement à d’autres appareils présumés "stridulatoires", les vibrations sonores, si tant est qu’elles existent réellement, se présentant alors comme un simple épiphénomène.
Note : Pour la M.E.B., les spécimens ont été examinés au microscope à balayage JEOL SM.35, après déshydratation et métallisation à l’or (Laboratoire de Microscopie électronique, Université des Sciences et Techniques du Languedoc, 34 Montpellier)
Liens externeshttp://www.owlapps.net/owlapps_apps/articles?id=13314147
Bibliographie
Berland, L.,1932.-
Les Arachnides. Encycl. Entomol.,XVI.
Paul Lechevalier & fils
edit.,Paris.
Busnel,R.G.,
1963.- Acoustic
Behaviour of Animals. Elsevier edit.
Chamberlin, R.V., 1924 –
Proc.Calif.Acad.Sciences, 12, p.
561-694.
Dierkens,M., 2011 - Contribution
à l'étude des Araneidae de la Guyane française. I : Gasteracanthinae ( Publications du musée des
Confluences, 2011, article)
Gaffal, K.P.
& K.Hansen,1972. – Z.Zellforsch.,132, p.79-94.
Gertsch,W.J.,1979.- American
Spiders. Van Nostrand Reinhold
Company.
Gertsch,W.J.,1982.- Assoc.Mexican
Cave Stud.Bull.,8, p.95-144.
Gwinner-Hanke,H.,1970
– Z.Tierpsychol.,27 (6), p.649.
Hawke,S.D.,
Farley,R.D. & P.D.Greany,
1973.-
Tissue Cell, 5 (1), p.171-184.
Fred H. Lahee, "The Calls of Spiders", Psyche: A Journal of Entomology, vol. 11, Article ID 032892, 1 page, 1904.
Lawrence,
R.F.,
1937- Ann.Natal.Mus., 8 (2),p.211-273.
Legendre,R.,
1958.- Ann.Biol.,34 (5-6),
p.193-223.
Legendre,R.,1963.-
Ann.Biol., II (7-8),
p.371-390.
Levi, H., 1985. -, « The spiny orb-weaver genera Micrathena and
Chaetacis (Araneae: Araneidae). », Bulletin of the Museum of Comparative
Zoology, vol. 150, no 8, p. 429-618, 1985
Lopez,A.,1973b
(en col. avec R.Legendre). – Les chromatophores de l’Araignée Holocnemus pluchei (Scop.)(Pholcidae)
(Note préliminaire). Bull. Soc. zool. France, 98 (4), p. 487-494.
Lopez,A.,1978.-
Bull.Soc.Et.Sci.nat.Béziers,N.S., V (46),1978, p.6-25.
Lopez,A.,1988.-
Bull.Soc.Et.Sci.nat.Béziers,N.S., XII (53),1987-1988, p.9-20.
Lopez,A.,1994a
(avec L.Juberthie-Jupeau).-
Bull.Soc.Et.Sci.nat.Béziers,N.S., XIV(55),1993-1994, p.32-37.
Lopez,A.,1994b (avec L.Juberthie-Jupeau).-Mém.Biospéol., XXI, 1994, p.91-96.
Lopez,A.,1996
(avec
L.Juberthie-Jupeau).-
Mém.Biospéol., XXIII, 1996, p.157-162.
Mc Iver,
S.B.,
1975 - Structure of Cuticular Mechanoreceptors
of Arthropods . Ann.Rev. Ent., 20, p. 381-397.
Millot,J.,1949-
Ordre des Aranéides in P.P.Grassé, éd. : Traité de Zoologie,VI,
Masson, Paris, p.589-743.
Pickard-Cambridge,
F.O., 1895-
Ann.Mag.Nat.Hist., 16 (6), p.371-373.
Rice,M.J.,
Galun,R. & L.H.Finlayson,1973 – Nature New.Biol., 241, p
;
286-288.
Rovner,J.S.,1975- Science,190,
p.1309-1310.
Rovner,J.S.,1980-
J.Arachnol., 8, p.193-200.
Simon,E.,1893 –
Ann.soc.ent.France, 62, p
;224-225.
Thurm,U.,1964 – Science, 145,
p.1063-1065.
Uetz,G.W. &
G.E.Stratton, 1982.- Acoustic communication and reproductive isolation
in Spiders in Witt & Rovner ed. : Spider
Communication. Mechanisms and Ecological Significance. Princeton Univ.
Press, p.123-159.
Westring
Sous-site en construction
