|
Glande tibiale des Lycosidae ANATOMIE DES ARAIGNEES : VINGT-CINQ ANS DE RECHERCHES |
| Le mâle de l' Araignée
Lycoside Alopecosa cuneata possède
dans le tibia de ses pattes antérieures une glande exocrine
particulière dont la sécrétion doit intervenir
dans l'accouplement (phéromone sexuelle) |
|
Couleurs
conventionnelles :
En violet,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
rouge, parties
les plus importantes
et résumés
|
|
Abréviations
conventionnelles :
M.E.B.
:
(photographie en) microscopie électronique à balayage
M.E.T. :
(photographie en) microscopie
électronique à transmission
C.H. : coupe histologique (microscopie photonique) |
1 - Introduction
Au sein de la famille des Lycosidae, alors que la femelle d' Alopecosa cuneata (Clerk) a des pattes antérieures d'aspect "normal" (Fig.1), le mâle se singularise toujours par un renflement tibial fusiforme qui apparait juste avant la dernière mue (Fig. 2,3).
 |
 |
 |
| Fig. 1- Alopecosa cuneata, femelle |
Fig. 2- Alopecosa cuneata, mâle |
Fig. 3 - Alopecosa cuneata, mâle (photo
Kronestedt) |
| PI, pattes
antérieures . Flèches : renflements
tibiaux des mâles |
||
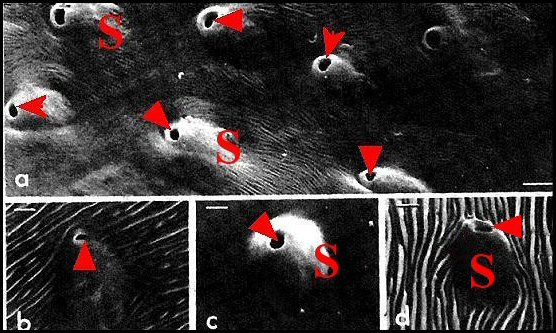
Ce renflement présente deux dépressions obliques pro et rétrolatérales tranchant, par leur teinte claire, sur la couleur noir intense de l’article. Il s’agit là d’un caractère sexuel secondaire propre au mâle, découvert par Sundevall (1832 : " tibias anticas crassissimas ovatas "), unique jusqu’ici chez les Lycosidae et jouant un rôle dans l’accouplement car la femelle l’étreint au cours des préludes (Kronestedt,1979) . Sa surface présente au M.E.B de nombreux pores cuticulaires sensés émettre un sémiochimique (Kronestedt,1986 : Fig.4), retrouvés par Dahlem & al.(1987) et en relation avec un organe sous-jacent que ces derniers n'auraient qu'entrevu dans des coupes sommaires.
 |
| Fig.
4- Alopecosa cuneata,
mâle : pores
cuticulaires.
M.E.B. (photo Kronestedt,1986) |
| S,
saillie oblique surélevant le pore. Flèches : pores
excréteurs. Fig.4b : pore non saillant |
L'auteur (Lopez,1990) a donc effectué sur le tibia un examen histologique plus complet, pris d'autres photos au M.E.B et réalisé en collaboration sa première étude ultrastructurale . Il s'agit là de la toute première recherche portant sur caractère sexuel glandulaire d’appendice prosomatique mâle autre que le pédipalpe.
Les mâles d’Alopecosa cuneata (Cl.) (Lycosidae) utilisés comme matériel, adultes et subadultes, ont tous été récoltés dans les Monts deLacaune (nord-ouest de l’Hérault, 34, France). Outre l'application de techniques histologiques banales, ils ont été préparés pour la microscopie à balayage ( M.E.B) et surtout,p our la microscopie électronique à transmission (1). Les diapositives de microscopie photonique ayant été perdues, les figures correspondantes présentées sont en noir et blanc.
2 - Le renflement tibial au M.E.B.
Chaque zone claire
latéro-tibiale se
présente comme une dépression en cuvette
peu profonde et presque
glabre qu'entourent des poils banaux. Chez les mâles
adultes, elle renferme généralement un
matériel amorphe, granulo-filamenteux, plus ou moins
craquelé et d'aspect sécrétoire.
 |
| Fig.
5- Alopecosa cuneata,
mâle : dépression tibiale.
M.E.B. |
| H,
poils - Ma, matériel amorphe sécrétoire.
Flèches : pores. |
Les pores découverts par Kronestedt (1986)
chez d’autres spécimens (Fig.4),
sont bien visibles sur les bords de cette même dépression (Fig.5). Ils s’y disposent sans ordre
apparent,
s’isolent parfois entre les bases de poils voisins et se
présentent comme des orifices arrondis,
réguliers(diamètre : 1,5 µm). Situés au
ras du tégument (Fig.4b) ou, beaucoup plus souvent, sur une
saillie oblongue les surélevant en position oblique (Fig.4a,c,d
; Fig.6,7), ces orifices présentent en gros
la même orientation. Certains d’entre eux émettent une
substance qui s’étire en filaments et se fond parfois dans le
contenu de la dépression.
 |
 |
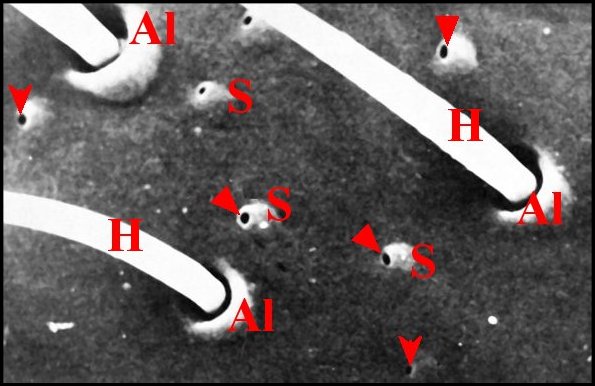
| Fig. 6 - Pores sur
saillies (sauf au bas de la figure) et bases de poils. M.E.B. |
Fig.7 -
Détail d'un pore. M.E.B. |
| Al,
alvéoles des poils ; H, poils ; S, saillies obliques
surélevant les pores. Flèches : pores |
|
3 - Structure histologique
Au niveau de chaque
dépression, l’épiderme
est modifié en regard des pores. Il est haut de 40 à 50
µm, recouvert par une cuticule
de même épaisseur et séparé d’un vaste sinus
hémolymphatique sous-jacent
par une basale peu visible
(Fig. 8,9).
L’épithélium
tégumentaire comporte
3 catégories de cellules.
► Les plus grandes ont un aspect d’adénocytes
globuleux (diamètre : 30
µm environ), à noyau arrondi
(6 à 7 µm) nettement
nucléolé, à cytoplasme basophile dans sa partie basale, spongieux
et
très éosinophile dans sa partie apicale où l’on
discerne un « réservoir » à
pourtour vaguement strié
ainsi qu’un grêle canalicule.
► Une deuxième
catégorie de cellules s’interpose entre les adénocytes
et la cuticule sus-jacente ; satellites
des canalicules, elles ont des limites peu
distinctes, contiennent des granulations pigmentaires et ont un petit
noyau anguleux (3-4 µm),
très chromatique, plus ou moins parallèle au
revêtement chitineux.
► La troisième
catégorie se compose de cellules interposées entre
les adénocytes qu’elles paraissent
soutenir ; renfermant aussi du pigment
dans leur cytoplasme étiré, elles sont
plus ou moins perpendiculaire à cuticule et montrent un noyau également très
colorable mais plus régulier et allongé
(jusqu’à
10 µm)(Fig.8,9).
Au voisinage immédiat de l' épiderme ainsi différencié en organe glandulaire, le revêtement épithélial montre encore une zone épaissie, d’aspect réticulé et lacunaire, avec quelques adénocytes inclus parmi les cellules très vacuolisées qui le constituent. Au delà, l'épiderme ne présente plus qu'un aspect banal : épithélium prismatique simple, à petites cellules régulières monomorphes, ne dépassant pas 10 µm de hauteur. Le sinus hémolymphatique a une ampleur inhabituelle et paraît plus responsable du renflement tibial que l' épiderme modifié. Il ne ménage qu’une place étroite pour les nerfs et les muscles, occupe presque tout le centre de l’article, renferme de petits vaisseaux qui s'y ouvrent et surtout, un quantité considérable d' hémocytes à disposition compacte. Ces cellules sont souvent granuleuses et paraissent se rattacher à 4 catégories distinctes que met surtout en évidence le bleu de toluidine.
Chez les mâles subadultes, le sinus est également très développé, riche en hémocytes mais l'épithélium glandulaire, bien que déjà épais et stratifié, ne montre pas de différenciation évidente en plusieurs catégories de cellules, notamment en adénocytes. De plus, le revêtement cuticulaire ne semble pas renfermer encore de canalicules.
 |
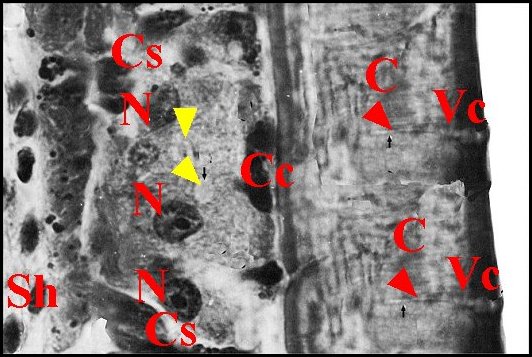 |
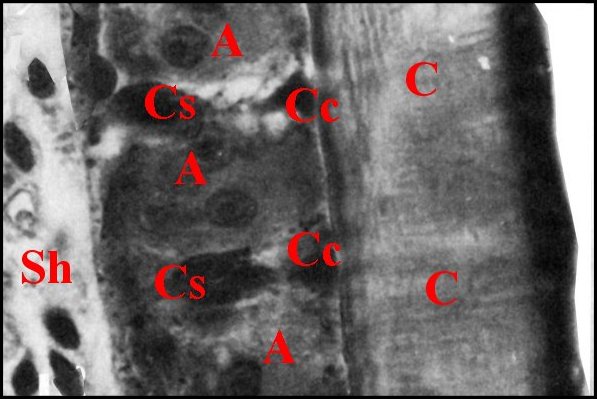
| Fig. 8 -
Epithélium de la dépression tibiale |
Fig. 9 -
Epithélium de la dépression tibiale : autre vue
avec 2 canalicules |
| A, adénocytes - C, cuticule - Cc, cellules canaliculaires - Cs, cellules de soutien - N, noyau - Sh, sinus hémolymphatique - Vc, vésicule claire. Flèches rouges : canalicules traversant la cuticule ; flèches jaunes : "réservoirs" d'adénocytes. (© A.Lopez C.H.) | |
4 - Ultrastructure
Son
étude est la première
réalisée sur une glande prosomatique appendiculaire
mâle autre que le pédipalpe.
Nos recherches au M.E.T. (Lopez,1990) montrent que l’épiderme
modifié est
formé par un ensemble d’unités
fonctionnelles bien
individualisées, autonomes, présentant toutes la
même
organisation ultrastructurale, et par des cellules
de soutien.
Une lame
basale très mince (30 nanomètres), continue et
finement granuleuse les sépare bien du sinus et ses
hémocytes.
Chaque unité fonctionnelle ou glandulaire se compose d’un adénocyte et d’un appareil cuticulaire s’étendant de cette cellule sécrétrice à l’un des pores de surface. Les différentes unités sont entourées par des cellules épithéliales de soutien.
4.1- Adénocyte
L’adénocyte
est
volumineux (30 µm), grossièrement pyramidal et repose sur
la lame
basale l’isolant du sinus hémolymphatique adjacent.
Sa membrane
plasmique
présente des replis en augmentant la surface, au
niveau des
faces latérales, qui s’engrènent avec les
adénocytes voisins, et
surtout au niveau du pôle
basal où
ils s’enfoncent profondément. De plus, elle
pénètre dans le pôle apical qui présente
ainsi une invagination de l’espace
extracellulaire vaste, profonde
et sinueuse, en “ cul de sac ” ou “ doigt de
gant ”. Ce “réservoir” est garni sur son portour par des
microvillosités (Fig.10, 11) ; il renferme, en position axiale,
un canalicule récepteur (partie initiale de l’appareil
cuticulaire) et un matériel
granulo-filamenteux, séparant comme un
« manchon », le conduit des microvillosités
(Fig.11). Ces
dernières sont
très nombreuses,
irrégulières, flexueuses contiennent des
microfilaments, présentent des densifications apicales
très
osmiophiles et se détachent parfois de lames saillantes entre
lesquelles la membrane cellulaire
pénètre
profondément dans le hyaloplasme. Les
« cryptes » ainsi formées sont surtout
visibles dans le compartiment
baso-latéral.
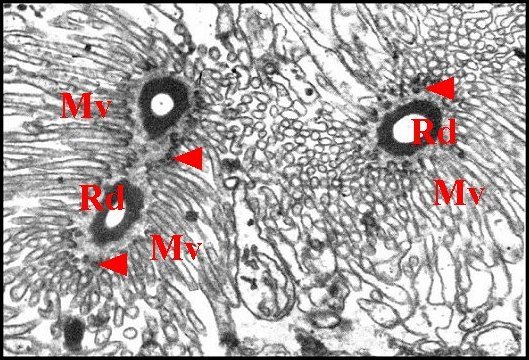 |
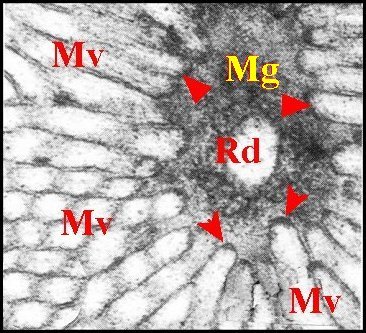 |
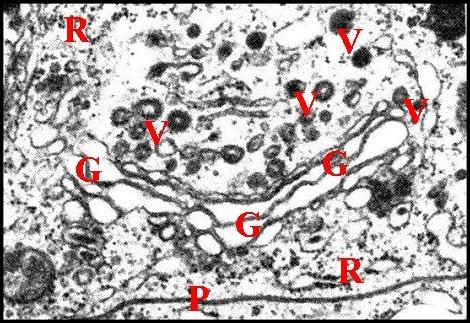 |
| Fig.10- Réservoir, canalicule
récepteur (3 sections). |
Fig.11-
Réservoir,
origine du canalicule. |
Fig.12 - Appareil de Golgi : dictyosome. |
| G, saccules golgiens - Mg, matériel granuleux en manchon - Mv, microvillosités - P, plasmalemmes accolés - R, réticulum endoplasmique granulaire - Rd, canalicule récepteur - V, vésicules. Flèches : densifications apicales osmiophiles. (© A.Lopez M.E.T.) | ||
Le noyau
est
volumineux, clair, plus ou moins arrondi,
parfois irrégulier. Il renferme
un gros nucléole
réticulé excentrique
et une chromatine peu
abondante, dispersée
ou réunie en
petites mottes périphériques. Son enveloppe
est pourvue
de pores très
apparents et délimite un espace
périnucléaire souvent
élargi, en relation avec les cavités du réticulum.
Les
organites
subcellulaires les plus
remarquables sont de petites mitochondries trés
nombreuses, allongées, cylindriques, plus ou
moins flexueuses, à crêtes parallèles,
siégeant dans les replis du pôle
basal et surtout,
prés de la cavité
extracellulaire où
elles peuvent s’engager dans les lames apicales. L’appareil de
Golgi est
constitué par des empilements de
saccules
membranaires (“dictyosomes”)
siégeant surtout en périphérie dans la
moitié basale de l’adénocyte
et
bourgeonnant de petites vésicules à
contenu dense (Fig.12). Le réticulum
endoplasmique, de type rugueux ou granulaire, siège
aussi en périphérie, au voisinage du noyau
mais
paraît peu développé. On note
aussi une grande quantité de ribosomes
libres, des lysosomes
hétérogènes dispersés et des
microfilaments.
Une activité
sécrétoire
est
représentée par les
vésicules denses golgiennes et,
semble-t-il, d’autres vésicules
siégeant au voisinage des empilements mais qui sont claires,
avec un
contour très net, bien dessiné par une fine membrane
lisse ; elles vont s’ouvrir entre les pieds des
microvillosités
et
au fond des « cryptes » entre les bases
des lames. Leur
contenu pénètre ainsi entre les microvilli et le
matériel
granulo-filamenteux dans l’espace
extracellulaire, dont il
semble gagner la partie profonde ou basale, formant à ce niveau
un « lac » de sécrétion,
homogène et modérément osmiophile.
4.2-Appareil cuticulaire
Il comporte
une portion
initiale réceptrice, une portion conductrice et des
cellules canalaires ou canaliculaires.
4.2.1- Portion réceptrice
Elle est
représentée par le canalicule
récepteur et se
loge dans la cavité
extracellulaire
où, d’abord excentrique, elle devient ensuite axiale et
décrit des sinuosités marquées de
sorte que
plusieurs de ses sections peuvent apparaitre dans une
même coupe
(Fig.10,
14). La paroi de ce canalicule, de nature
épicuticulaire probable,
est formée par
une couche unique entourant la lumière, assez dense,
lisse
et régulière sur sa face interne, un peu
mamelonnée sur sa face externe(Fig.10), non
fenestrée mais vraisemblablement interrompue à
l’origine du canalicule où elle semble s'ouvrir
directement dans la partie basale de la cavité extracellulaire
(Fig.11). La sécrétion du
«lac» se
retrouve fréquemment dans la lumière du
canalicule qu'elle emplit.
Le
canalicule récepteur constitue un "appareil terminal" ("end
apparatus") typique
avec les microvillosités
qui l’entourent et s'ancrent par leurs densifications apicales sur le manchon granulo-filamenteux
(Fig.10,11).
Il
s’abouche
à la portion
conductrice qui
est dans son prolongement direct (Fig.13).
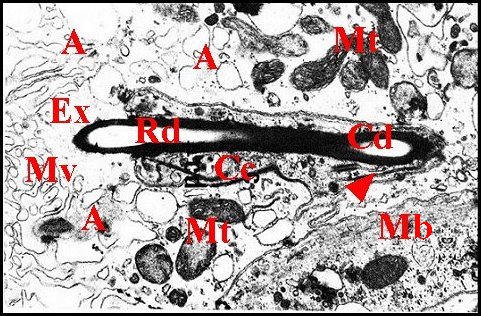 |
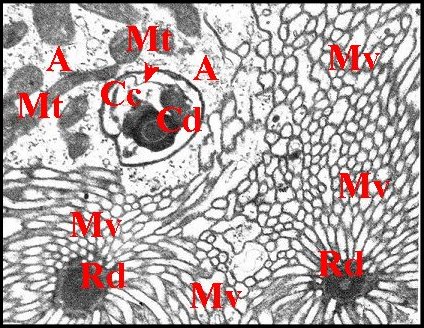 |
| Fig.13 - Les
deux portions canaliculaires, coupe
oblique. |
Fig.14 - Les
deux portions
canaliculaires,
coupe transversale. |
| A, adénocytes - Cc, cellule canaliculaire - Cd, portion (canalicule) conductrice - Ex, cavité extracellulaire - Mb, microtubules dans une cellule de soutien - Mt, mitochondries - Mv, microvillosités - Rd, portion (canalicule) réceptrice, deux sections. Flèches : méso de la cellule canaliculaire (© A.Lopez M.E.T.). | |
4.2.2-
Portion conductrice
Elle est formée par
un canalicule
conducteur ou
excréteur,
simple,
isolé des autres conduits depuis l’adénocyte
jusqu’à sa terminaison poraire, lui aussi très
long et
sinueux. Ce canalicule présente une lumière
ovale
ou
arrondie, d’un calibre plus
gros que celui de la portion
réceptrice, allant
d’ailleurs en croissant, et
une paroi
formée par une seule couche d’épicuticule, dense,
opaque et homogène, compacte, ininterrompue,
très
osmiophile, lisse intérieurement et
irrégulière
sur sa face externe. Lors de sa traversée de la
cuticule, et
juste
avant d’en atteindre la surface,
il se dilate en une chambre
ampullaire ovoïde
(D = 2,8 µm)(Fig.15) correspondant à la
« vésicule » claire des coupes
histologiques et s’ouvrant à l’extérieur par le pore,
surélevé ou non.
Le canalicule conducteur ou excréteur
est presque
entièrement
logé dans une cellule canaliculaire. Haut
située dans l'épiderme modifié, elle est
entourée par d’autres éléments du
même type
ou par des cellules épithéliales de soutien, a des contours très
irréguliers, des prolongements lui donnant un aspect
« stellaire » et s'enroule autour du
canalicule conducteur ; l’accolement de ses
faces affrontées donne naissance à un très long
méso sinueux que ferme un desmosome (Fig.16).
Le noyau est irrégulier
et contient
une chromatine
abondante, en mottes
marginales
denses. Le cytoplasme, étroit et clair, renferme du
réticulum, des
grains sphériques
denses de pigment
mélanique et ne montre pas d'activité
sécrétoire.
La cellule canaliculaire pénètre,
par une expansion, dans la partie
supérieure de la cavité extracellulaire de
l'adénocyte auquel elle
est unie par une jonction, l’obture
comme un bouchon et y
englobe le canalicule
conducteur dès
son origine. Un autre prolongement accompagne le canal dans la
partie profonde de sa traversée cuticulaire
où il l’isole
de l’endocuticule voisine.
D’autres enfin s’insinuent entre les
cellules
épidermiques adjacentes.
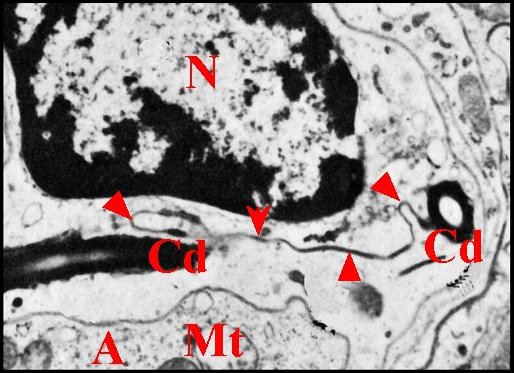
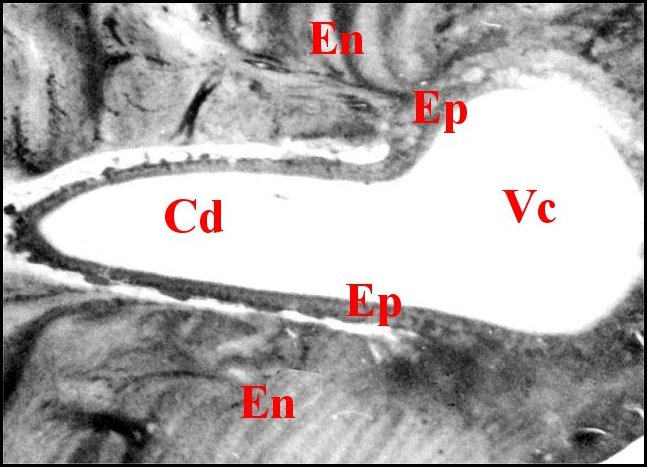 |
 |
| Fig.15 - Canalicule
conducteur et sa vésicule ou
chambre
ampullaire.
|
Fig.16 - Cellule canaliculaire et son
méso sinueux. M.E.T. |
| A,
adénocyte - Cd, canalicule conducteur - En, endocuticule - Ep,
épicuticule - Mt, mitochondrie - N, noyau de la cellule
canaliculaire- Vc,
vésicule canaliculaire. Flèches : méso. (© A.Lopez M.E.T.). |
|
4.3- Cellules épithéliales (épidermiques) de
soutien
Etendues
de
la lame basale à la cuticule,
elles
sont volumineuses, grossièrement
prismatiques et réunies
par des jonctions (desmosomes)
lorsqu’elles se juxtaposent.
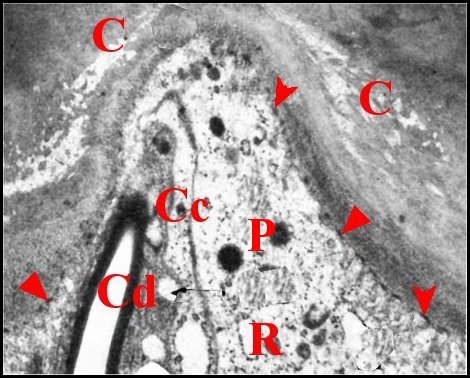
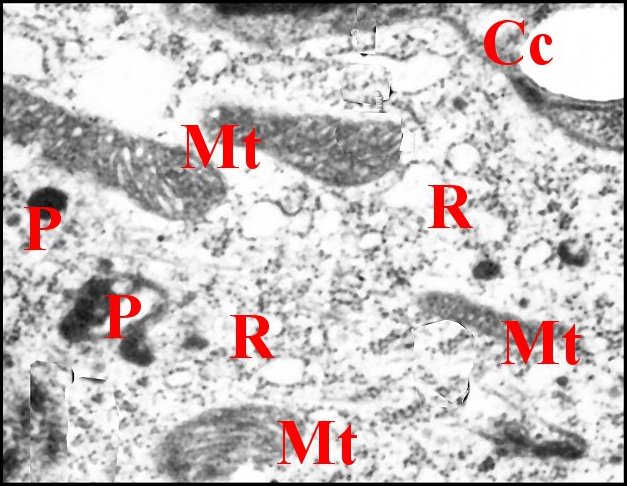
Le pôle apical ne présente pas d’invagination de l’espace extracellulaire, est hérissé de microvilli courtes, trés serrées, avec des densifications appliquées sur la cuticule (Fig.17) et émet aussi quelques prolongements s’engageant dans les canaux poraires.
 |
 |
| Fig. 17 - Apex
d'une cellule de soutien et cellule canaliculaire. |
Fig. 18-
Centre
d'une cellule de soutien, cellule
canaliculaire. |
| C, cuticule
(partie profonde) - Cc, cellule canaliculaire- Cd,
canalicule
conducteur - Mt, mitochondries - P, pigment - R, réticulum
endoplasmique granulaire. Flèches : densifications apicales des microvilli.(© A.Lopez M.E.T.). |
|
Les faces
latérales sont nettes,
presque rectilignes et non engrenées.
Le pôle
basal présente des hémidesmosomes
nombreux, petits et
rapprochés qui l’ancrent sur la lame
sous-jacente.
Le noyau rappelle celui des cellules canaliculaires, est assez irrégulier, pourvu d’une chromatine marginale abondante et d’un nucléole dense. Le cytoplasme renferme des ribosomes libres, un réticulum endoplasmique granulaire formé par de très nombreuses petites vésicules, des mitochondries plus grosses que celles de l’adénocyte, à crêtes serrées, un appareil de Golgi réduit, semble-t-il, à quelques dictyosomes, et des inclusions pigmentaires sphériques (Fig.18). On note aussi en périphérie des faisceaux de microtubules et de microfilaments qui ont une disposition longitudinale (Fig.14).
5 - Commentaires
1- Sur le plan anatomique, le renflement tibial des
pattes I d' Alopecosa cuneata
mâle
se présente comme un organe assez complexe, associant
une glande
épidermique exocrine et un vaste
sinus sanguin qui
n’a pas
donné lieu à des recherches plus poussées.
La glande et la
cuticule sus-jacente peuvent
être
rattachées au cadre
restreint des équipements sécréteurs connus dans
les pattes de certaines
Araignées : également dans le tarse I des mâles d' Arkys
(Araneidae), Ablemma et Brignoliella (Tetrablemmidae); dans
les fémurs et tibias des deux sexes chez les Zodariinae, Telemidae, Leptonetidae, Agelenidae (Cybaeota)
La structure fine des
unités constituant la glande tibiale permet
de les rattacher à la classe 3 des
cellules
glandulaires épidermiques telles
que Noirot et Quennedey (1974)
les ont décrites chez les Insectes.
L’adénocyte se
singularise
par des microvillosités souvent groupées
sur des lames
cytoplasmiques non
observées dans les autres glandes
d’Araignées et par la richesse
de son
chondriome.
Responsable de l’éosinophilie cytoplasmique observée
en
histologie, un nombre aussi élevé de mitochondries n’a guère
été observé ailleurs que dans les
glandes
épidermiques sous-oculaires (appelées à tort
« clypéales ») des Mynoglenes,
mâles et femelles (Blest
& Taylor, 1977). Il suggère
dans l'adénocyte tibial des transferts et un
métabolisme
intenses pouvant être en rapport avec l’un des stades
de
l’activité sécrétoire.
Le canalicule
récepteur
est remarquable par ses sinuosités, par
l’absence de
fenestrations pariétales et par son ouverture dans
l’espace
extracellulaire vraisemblablement terminale comme dans la glande
labio-sternale et la glande
rétrogonoporale . Le canalicule conducteur
se
singularise lui aussi par des
sinuosités et surtout, la dilatation ampullaire
sub-terminale
non rencontrée dans
d’autres glandes.
2- Sur le plan
fonctionnel,
l’ultrastructure particulière de la
glande tibiale
qui comporte un appareil terminal dans chacune de se unités, plaide en faveur d’une
sécrétion de phéromone sexuelle par analogie avec celles
d’autres organes Araneidiens (glande
acronale ou clypéale)
ou de nombreuses glandes d’ Insectes.
Ici plus qu’ailleurs, le
rejet
des sécrétats doit être lié
à la pression que l'hémolymphe exerce sur les
adénocytes en s’accumulant dans
le vaste sinus. Lescellules sanguines pourraient leur avoir
préalablement transmis
des métabolites particuliers.
Le matériel
élaboré
sort ensuite par les pores
et
emplit les
dépressions latérales du tibia.
Il renferme
probablement un sémiochimique volatile exerçant
sur
la femelle, un effet
d'abord attractif,
lorsqu’elle s’approche du mâle, saisit ses tibias avec les
chélicères lors de premiers contacts
très fugaces, et
ensuite "aphrodisiaque", lorsqu’elle
l’étreint
plus longuement, rapprochant ses parties buccales de la
sécrétion (Kronestedt,
1979).
Il
semblerait d’ailleurs que les premiers tibias
d’une autre Lycoside,
Xerolycosa
miniata,
présentent également de
nombreux
pores chez le mâle (Kronestedt,obsv.pers.) et soient
saisis par la
femelle lors de la cour (Bristowe, 1929 ;
Kronestedt, obsv.pers.).
Note 1 : Laboratoire
CNRS, Moulis 09200 : fixation des parties étudiées
au glutaraldéhyde à 2,9% dans le tampon Millonig 0,2 M),
post-fixation au tétroxyde d’osmium à 0,2% dans le
même tampon, et inclusion en épon ; coupes fines au
microtome Reichert OM U2 contrastées par l’acétate
d’uranyle, le citrate de plomb et examinées ensuite sous 50 KV,
au microscope Sopelem du Laboratoire souterrain
(Microscopie
électronique à transmission : M.E.T.).
Bibliographie
Blest,A.D. & H.H.Taylor, 1077 - The Clypeal glands of Mynoglenes and of some other Linyphiid Spiders. J.Zool., 183, p.473-492.
Bristowe, W.S., 1929. - Proc.Zool.Soc.London, 1929, p.309-358.
Dahlem,B.,Gack,C.
& J.Martens,1987.- Zool.Breitr.,NF 31, p.151-164.
Kronestedt,T.,
1979.- Ent.Tidskr., 100, p.194-199.
Kronestedt,T.,1986.- Psyche,
Cambridge, 93, p.127-131.
Lopez,A.,1990 (avec L.
Juberthie-Jupeau et T. Kronestedt). – Revue Arachnol., 9 (6), 1990, p.
63-77.
Noirot,
Ch. & A.Quennedey, 1974.-
Ann.Rev.Entomol.,19, p.61-80.
Sundevall,C.J.,1982.-
Kongl.Svenska
Vetensk Akad. Handl., 1832, p. 171-272.