|
Glande
rétrogonoporale
(Leptyphantes sanctivincentii) ANATOMIE
ET COMPORTEMENT DES ARAIGNEES :
VINGT-CINQ ANS DE RECHERCHES
(Version 2023) Par André LOPEZ, auteur |
| Une glande épidermique originale bien délimitée incluse dans la lèvre postérieure de la fente épigastrique chez la femelle de l'Araignée cavernicole Leptyphantes sancti-vincentii et probablement productrice de phéromone sexuelle.Elle ne doit pas être confondue avec la glande rétrognathocoxale , l'une des glandes segmentaires, qui elle, est située dans le céphalothorax ou prosoma, en arrière de la gnathocoxe ou lame maxillaire, à proximité de la glande coxale proprement dite. |
|
Couleurs
conventionnelles :
En noir et italiques, termes anatomiques ; en violet,,
noms
génériques et spécifiques ; en vert, noms de
familles et sous-familles ; en
orange,, parties
les plus importantes
et résumés; en bleu, liens divers.
|
| Abréviations
conventionnelles : M.E.B. : (photographie en) microscopie électronique à balayage M.E.T. : (photographie en) microscopie électronique à transmission C.H. : coupe histologique (microscopie photonique) |
1 - Introduction
2 - Description
2.1 - Anatomie
1 - Introduction
On sait
que les femelles d’Araignées attirent leurs mâles par
des phéromones
de contact, déposées ou non
sur le substrat, et par des phéromones volatiles agissant
à distance.
Ces sémiochimiques
facilitent le
rapprochement des sexes dans les manœuvres préliminaires
à la copulation (Krafft,1980 ;
Tietjen & Rovner,1982).
Leur
production
a été d’abord attribuée au
« tégument »
des femelles, sans
préjuger s’il comporte
ou non des zones sécrétrices privilégiées.
Des études histologiques ultérieures
(Kovoor,1981 ; Lopez,1981b) ont
permis d’évoquer la région
génitale où
certaines des glandes
montrent des indices structuraux d’une
sécrétion phéromonale : adénocytes
volumineux, à gros noyau
clair, pourvus d’un
« réservoir »
acidophile
intra-cytoplasmique et d’un canalicule
excréteur qu’entoure sa cellule
« satellite ».
Ces glandes
siègent dans l’épiderme
de l’atrium génital,
de l’épigyne et surtout, dans
celui des
deux lèvres
du sillon (fente) épigastrique ou génital, en
particulier chez les
femelles d’Entélégynes : Oecobiidae, Thomisidae, Agelenidae, Lycosidae, Uloboridae, Araneidae (Kovoor,1981);
Linyphiidae (Lopez,1981b).
Elles y sont généralement
dispersées sans ordre
apparent.
L'auteur a toutefois découvert
chez Leptyphantes
sanctivincentii, une espèce de la
dernière famille, taxon rebaptisé aujourd'hui par certains, on
ne sait trop
pourquoi, "Pseudomaro
aenigmaticus", que les glandes
présumées
phéromonales peuvent se grouper en un
véritable organe
bien individualisé dans la lèvre
postérieure du
sillon épigastrique, donc de l’orifice génital, et qu'il a ainsi qualifié de
"post-gonoporal" (Lopez,1979b).
Avec ses collaboratrices, il a utilisé comme matériel d'étude Leptyphantes sanctivincentii (Simon) (Linyphiidae) (grotte de Cailhol, Minervois : Ouest de l’ Hérault, Occitanie, France) d'abord examiné en C.H. au microscope photonique puis en M.E.B. et enfin en M.E.T. au Laboratoire souterrain du CNRS, Moulis 09200.
2 - Description
2.1- Anatomie
La
glande rétrogonoporale
n’existe que chez la femelle
adulte. Elle siège dans la lèvre
postérieure
du sillon épigastrique,
très
près de la
face ventrale, et y est surplombée
par l’épigyne (Fig.1,
2)
 |
 |
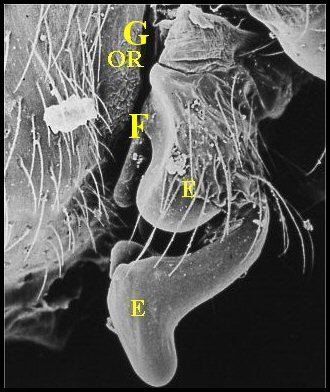
| Fig.1
-
Vue latérale de la région épigastrique au M.E.B.
|
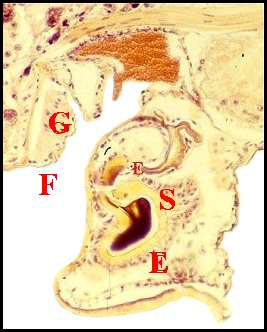
Fig. 2 -
Coupe
histologique sagittale de la région épigastrique |
| E, épigyne - F, fente ou sillon épigastrique - G (OR), organe ou glande rétrogonoporal(e) - S, spermathèque (© A.Lopez C.H. et M.E.B.) | |
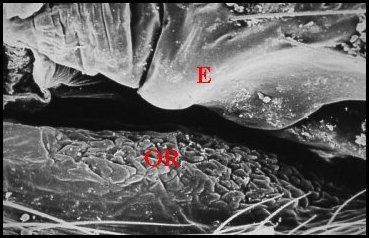
Vu au M.E.B. (Lopez,1981b),
cet organe se présente
extérieurement comme un bourrelet
transversal très
saillant, orientant sa convexité vers la fente
épigastrique, étendu
sans
interruption
entre les deux stigmates
pulmonaires, et
séparé de la même fente par une étroite
« rigole » réunissant ces deux orifices
respiratoires. Il est long
d’environ 300 µm et large
de 70. Sa
surface est tourmentée, irrégulière, toute en
dépressions et replis, d’aspect
« gaufré » ou
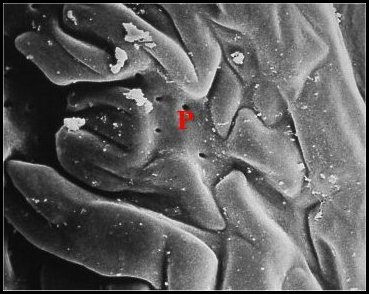
« cérébriforme » (Fig.3,4),
parsemée
de pores
excréteurs
arrondis (1 µm de diamètre moyen), réguliers,
sans
margelle, isolés ou plus souvent réunis en
petits groupes
(Fig.4). L’aspect d’ensemble suggère
un dispositif d’évaporation ou de diffusion.
 |
 |
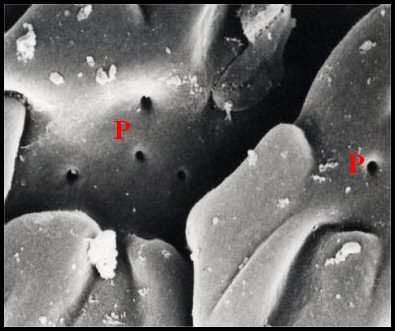 |
| Fig. 3 - Vue de l'organe postgonoporal (OR) en bourrelet transversal (© A.Lopez M.E.B.) | Fig. 4 - Détails de sa surface montrant des replis et des pores (P) (© A.Lopez M.E.B.) | |
2.1- Structure histologique
Au niveau du bourrelet et de ses pores, l’épiderme
sous-jacent est considérablement
modifié. Il présente
un massif épithélial dense, beaucoup plus épais
que lui, convexe et un peu en forme d’éventail dans les coupes
(para)sagittales (Fig.5), en bourrelet incurvé dans les
transversales (Fig.6), épais d’une quarantaine de microns
et recouvert par une mince cuticule
sinueuse (Fig.7).
Un petit sinus
hémolymphatique et des fibres
musculaires striées le
séparent des diverticules
chylentériques, du tissu interstitiel et des glandes
séricigènes.
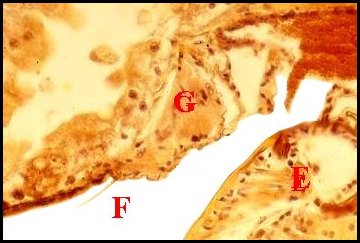 |
 |
| Fig. 5 - Coupe histologique sagittale de l'organe rétrogonoporal (G) |
Fig.
6 - Coupe histologique transversale de l'organe
rétrogonoporal (G)
|
|
E,
épigyne ; F, fente épigastrique ; G, glande
rétrogonoporale ; S, glande à soie (© A.Lopez C.H.)
|
|
L’épithélium
tégumentaire modifié comporte 4 catégories de
cellules.
► Les plus grandes ont un aspect d’adénocytes allongés et pyramidaux (hauteur : 25 à 30 µm environ) dont le noyau arrondi (diamètre : 8 µm environ), clair et vésiculeux montre un gros nucléole central et une chromatine périphérique très fine. Dans sa partie apicale, le cytoplasme de chaque adénocyte renferme une zone éosinophile ovoïde, en « réservoir », avec de fines stries radiaires convergeant vers une densification axiale. Il s’en détache un bref canalicule excréteur ralliant le revêtement cuticulaire (Fig.7).
 |
| Fig.
7 - Coupe histologique sagittale de l'organe rétrogonoporal,
détail (rotation 90°) C, cuticule ; D, canalicules ;N, noyau adénocytaire ; R,
"réservoir" |
► Une deuxième
catégorie de cellules se loge entre les adénocytes et la cuticule sus-jacente ;
accompagnant les
canalicules, ces cellules canalaires ont un cytoplasme étroit, peu visible, et
un petit noyau irrégulier très
chromatique.
► La troisième
catégorie se compose de cellules s’insinuant entre les adénocytes qu’elles paraissent soutenir,
pouvant être ainsi qualifiées de satellites, plus ou moins
perpendiculaires à
la cuticule et reconnaissables à leur noyau aplati, allongé
(jusqu’à 10 µm) et d’aspect
« tigré ».
► La dernière
catégorie semble correspondre à des cellules épidermiques, visibles dans la
périphérie de l’organe et entre les cellules canalaires.
Le revêtement
cuticulaire
sinueux est traversé par les canalicules excréteurs, issus des adénocytes sous-jacents, très
grêles, réunis en petits faisceaux et aboutissant chacun
en surface à l’un des pores ténus
décelés au M.E.B (Fig.4).
A quelque distance de l’épiderme ainsi transformé en
organe sécréteur, le revêtement
épithélial renferme encore quelques cellules glandulaires isolées. D’autres adénocytes sont également
logés dans l’épiderme ventral, un peu en arrière
de l’organe
post-gonoporal.
La différenciation de ce dernier s’ébauche chez la
femelle subadulte, pendant la dernière intermue, dans un
épaississement post-épigastrique de l’épiderme, et se complète ensuite
chez l’individu mature. Les adénocytes sont identifiables avant les cellules canalaires et satellites.
Il est à noter que les mâles en sont totalement
dépourvus, la glande
post-gonoporale
étant remplacée par une hernie de tissu interstitiel et par quelques fibres musculaires que recouvre du tégument pigmenté banal. En revanche, la lèvre
antérieure de
leur sillon
génital contient
des organes
acineux prégonoporaux, faisant partie d’un appareil épigastrique (confere supra) absent chez les femelles.
2.2- Ultrastructure
Nos
recherches au M.E.T.(Lopez,1989) montrent
que l’épiderme rétro-gonoporal modifié est
formé par un ensemble d’unités
fonctionnelles bien
individualisées, autonomes, présentant toutes la même
organisation ultrastructurale, et par des cellules
satellites,
« compagnes » ou de soutien.
Une lame basale
continue, très mince (quelques nm) et finement grenue les
sépare bien du muscle sous-jacent et du sinus. Elle suit les sinuosités des
pôles basaux adénocytaires et surtout, celles, beaucoup
plus marquées, des cellules de
soutien
Chaque unité
fonctionnelle ou glandulaire
se compose d’un adénocyte
et d’un appareil cuticulaire
s’étendant de cette cellule
sécrétrice à l’un des pores de
surface (Schéma).
 |
| Schéma - Unité
fonctionnelle rétrogonoporale périphérique.
Les cellules compagnes et épidermiques ne sont pas
représentées |
| Cc, cellule canaliculaire ; Cd,
canalicule conducteur ; Cm, corps myéloïde ; En,
endocuticule ; Ep, épicuticule ; Ex, cavité
extracellulaire ; G, dictyosome (Golgi) ; L, lysosome ; Mt,
mitochondrie ; Mv, microvilli ; N, noyau ; P, pore ; R,
réticulum ; Rd, canalicule récepteur ; V,
vésicule. |
2.2.1-Adénocyte
L’adénocyte
est volumineux (30 µm),
grossièrement pyramidal, repose sur la
lame basale et est flanqué par des cellules satellites ou
de soutien (Fig.8).
Son plasmalemme s’accole à celui des
cellules voisines au niveau des faces latérales qui ne sont pas
engrenées. Au niveau du pôle basal, il ne présente que
quelques replis irréguliers ne compartimentant pas le cytoplasme. En revanche, il pénètre dans le pôle apical qui présente
ainsi une invagination de l’espace
extracellulaire, en “ cul de sac ” ou “ doigt de
gant ”, peu profonde, n’atteignant pas la moitié basale et
obturée par la cellule canaliculaire
dans
sa partie apicale (Schéma). Cette cavité
correspond au « réservoir »
de la microscopie optique. Grossièrement ovoïde et longue
d’environ 7 µm, elle est garnie sur tout son pourtour par des microvillosités et
renferme, en position axiale, un canalicule
récepteur (partie initiale de l’appareil cuticulaire)(Fig.8 à 10). Un feutrage
fibrillaire très dense, et vaguement stratifié dans les
coupes longitudinales, estompe les contours du conduit et le
sépare comme un « manchon » des
microvillosités. Ces dernières sont nombreuses, coniques, assez
régulières, longues d’environ 1,5
µm, adoptent une disposition radiaire centrée sur le canalicule et ne ménagent entre
elles que des interstices étroits, presque virtuels. Elles
contiennent des microfilaments ténus,
convergeant vers des densifications
apicales osmiophiles discrètes.
 |
 |
 |
| Fig.8.- Adénocyte: cavité
extracellulaire et canalicule
récepteur (flèche), coupe oblique (ME.T) |
Fig.9.- Adénocyte: cavité
extracellulaire et canalicule
récepteur (flèche), coupe transversale
(ME.T) |
Fig.10.- Adénocyte: fond de la cavité extracellulaire,
coupe transversale. Le
canalicule n'est plus visible (M.E.T.) |
| A,
adénocyte voisin ; Cs,Cellule satellite ; Dy, dictyosome (Golgi)
; Ex, cavité extracellulaire ; M, mitochondrie ; Mv, microvilli
; V, vésicules golgiennes allant s'ouvrir entre les .
pieds des microvilli (Fig.10 : flèches). |
||
Le noyau est situé au-dessous de
l’invagination, dans la moitié basale
de l’adénocyte. Il est volumineux, arrondi,
régulier, renferme un nucléole
réticulé excentrique ainsi
qu’ une chromatine granuleuse, dispersée
dans le nucléoplasme ou réunie en petites
mottes. Son enveloppe est pourvue de nombreux pores très apparents.
Le cytoplasme contient divers organites subcellulaires dont aucun ne semble
particulièrement développé.
Le réticulum endoplasmique est constitué par des
sacs aplatis ou cisternae et par des vésicules. Les cisternae sont pour la plupart
granulaires, assez courtes, parallèles à la surface de la
cellule ou s’enroulent sur elles
mêmes, adoptant alors parfois une disposition en
« bulbe d’oignon » dans le voisinage du noyau. D’autres ne portent que de
rares ribosomes et peuvent s’accoler à
la face externe des complexes
golgiens. Les vésicules du réticulum sont également à
peu prés lisses et se fusionnent parfois en chapelet
à la base des microvilli.
L’appareil de Golgi est constitué par un
ensemble d’empilements membranaires (“dictyosomes”), sans localisation
précise. Leurs saccules sont nombreux, très
serrés et bourgeonnent par les bords de petites vésicules à contenu osmiophile
granuleux qui les remplit entièrement ou ne revêt que la
face interne de leur membrane (« vésicules tapissées »). Elles se
fusionnent souvent en grains denses et gagnent ensuite le
réservoir (Fig.9,10).
Les mitochondries sont petites, nombreuses,
irrégulières, pourvues de crêtes d’orientation variable et
réparties sans ordre apparent dans tout le cytoplasme (Fig.9,10).
On note aussi de petites vésicules d’endocytose naissant entre les pieds
microvillositaires, des ribosomes libres (polysomes) et des lysosomes secondaires autophagiques
siégeant surtout entre le noyau et la cavité extracellulaire. Pouvant atteindre une taille
importante (300 nm), ces derniers organites contiennent des corps myéloïdes à très
nombreuses lamelles
concentriques ainsi que des vésicules
réticulaires
et golgiennes d’aspect parfois
« vermiculé », qu’ils ont absorbées.
 |
 |
 |
| Fig. 11-
Adénocyte : lysosomes (M.E.T.). |
Fig. 12-
Adénocyte : gros corps myéloïde (M.E.T.). |
Fig. 13-
Adénocytes : lysosomes (M.E.T.). |
| Cm, corps
myéloïde (lysosome) ; Dy, dictyosome ; Ip, inclusioin
paracristalline dans une cellule compagne ; L, lysosomes ; Mt,
mitochondrie ; Mv, microvilli ;
N, noyau ; P, plasmalemme ; R, réticulum |
||
Une activité sécrétoire est représentée par les vésicules du réticulum et par celles de l’appareil de Golgi. Elles vont s’ouvrir dans l’espace extracellulaire entre les pieds des microvilli (Schéma, Fig..10),
et y déversent leur contenu (chapelets, grains denses)
après s’être parfois fusionnées.
2.2.2-Appareil cuticulaire
Comme dans le cas de diverses autres glandes (confere supra), il comporte deux portions bien distinctes dont les noms sont inspirés par la terminologie des entomologistes (Quennedey & Brossut, 1975 ; Sreng, 1979 ; Bitsch, 1981) : un canalicule récepteur, logé dans la cavité extracellulaire de l’adénocyte, et un canalicule conducteur s’étendant de l’adénocyte au pore cuticulaire (Schéma).
La portion initiale réceptrice plonge dans la cavité extracellulaire qu’elle paraît axer (Fig.9,
Fig.14). Brève, elle ne décrit pas de
sinuosités (Fig14). La paroi de ce canalicule récepteur, de nature épicuticulaire probable, est formée par
une couche unique, très mince, homogène, dense, lisse et
régulière, entourant une lumière à contenu
granuleux ;
non
fenestrée, elle s’interrompt peut être à
l’extrémité libre du canalicule, s’y ouvrant directement dans
la partie basale de la cavité extracellulaire.
 |
| Fig.14.- Canalicules
récepteur et conducteur,
coupe oblique (M.E.T.). |
| Cd,canalicule conducteur. Les
microvilllosités (Mv) et le canalicule récepteur (Rd)
qu'entoure un feutrage fibrillaire constituent l "appareil terminal". |
L’ensemble du canalicule récepteur, du feutrage fibrillaire qui l’entoure comme un manchon
et des
microvillosités ancrées sur ce dernier
par leurs
densifications apicales constitue un
“ appareil
terminal ”(“ end apparatus ”) typique tel qu’il est
décrit chez les Insectes dans sa diversité (Noirot &
Quennedey, 1974 ; Bitsch & Palevody,
1976) (Fig.14).
Le canalicule récepteur s’abouche à la portion conductrice qui est dans son prolongement direct (Fig.14). Elle est formée par un canalicule conducteur ou excréteur, simple, isolé des autres conduits, subrectiligne et trés court, sa longueur n’excédant pas 9 µm). Ce canalicule présente une lumière arrondie, d’un calibre plus gros que celui de la portion réceptrice, allant en croissant jusqu’à la terminaison (1/2 µm de diamètre interne), et une paroi formée par une seule couche d’épicuticule. Cette dernière est dense, opaque, homogène, compacte, ininterrompue, osmiophile, d’épaisseur également croissante (jusqu’à 0,2 µm)de sa traversée de la cuticule, lisse intérieurement, bosselée sur sa face externe et se raccorde à l’épicuticule tégumentaire au niveau du pore excréteur.
 |
 |
 |
| Fig.15.- Canalicules
conducteurs, coupe transversale |
Fig.16.-Détail
: canalicule conducteur et sa cellule |
Fig.17.-Détail :
canalicule conducteur, sa cellule |
| A,
adénocytes ; Cd, canalicule conducteur entouré par sa
cellule (Dc) ; Cs, cellule de soutien ; N, noyau de cellule
épidermique. Flèches : méso de
plasmalemme. |
||
Le canalicule conducteur ou excréteur est presque entièrement
logé dans une cellule canaliculaire (Schéma, Fig.15 à
17). Située dans la moitié supérieure de l’épiderme modifié, elle y est
entourée par d’autres éléments du même type,
par des cellules de
soutien et coiffe
le pôle apical de l’adénocyte correspondant ainsi
séparé de la cuticule. Elle a des contours
irréguliers, émet des prolongements descendants
et s’enroule autour du canalicule conducteur, l’accolement de ses faces
affrontées donnant naissance à un long méso flexueux clos
par un desmosome (Fig.16,17).
Elle pénètre, par un prolongement en digitation trapue, dans la
partie supérieure de la cavité extracellulaire de l’adénocyte auquel l’unit une jonction septée annulaire, l’obture comme un bouchon et
y englobe
ainsi le canalicule
conducteur
dès son origine. Les autres
prolongements sont des lames cytoplasmiques aplaties, s’insinuant entre
les faces
latérales de l’adénocyte et les cellules voisines (Schéma). Le noyau de la cellule canaliculaire est assez irrégulier, anguleux,
large denviron 3,8 µm et renferme une chromatine bien contrastée, se
condensant en mottes marginales. Le cytoplasme contient des polysomes, quelques vésicules de réticulum, des mitochondries ovoïdes, des groupes de microtubules à disposition
longitudinale et ne montre pas d’activité sécrétoire.
Déjà unie à l’adénocyte, la cellule canaliculaire s’engrène avec ses voisines, et, en périphérie de l’organe, avec les cellules épidermiques banales. Cette cohésion est renforcée par des desmosomes sub-apicaux.
2.2.3- Cellules compagnes ou de soutien
Etendues de la lame basale à la cuticule, elles sont allongées,
très aplaties, s’insinuent entre les adénocytes et entre les cellules canalaires qu’elles
entourent de manière très variée.
Le pôle apical ne
présente pas d’invagination de
l’espace extracellulaire mais est
garni de microvillosités trapues lorsqu’il atteint la cuticule. Fait
particulier, le pôle basal est découpé (lacinié)
en
compartiments d’une grande irrégularité par des
invaginations très profondes du plasmalemme ;
il s’ensuit que la lame basale pénétre dans ces replis et
remonte ainsi vers la surface, jusqu’à mi-hauteur de
l’organe ; sur la cuticule et émet aussi quelques prolongements
s’engageant dans les canaux poraires.
Le noyau, aplati comme la cellule, se situe à un niveau variable, le plus souvent dans la partie basale ; mesurant environ 5 µm, il contient une chromatine très dense, formant des mottes périphériques. Le cytoplasme renferme une très grande quantité de ribosomes, quelques vésicules de réticulum endoplasmique, des mitochondries sphériques non associées aux laciniures ou compartiments basaux, des faisceaux de microtubules et, surtout, des inclusions paracristallines en images négatives. Ces cavités sont rarement ovalaires,plus souvent bacilliformes, rectilignes ou coudées (Fig.13,18,19), atteignent une longueur de 3,5 µm et paraissent en rapport avec les membranes du réticulum.
 |
 |
|
| Fig. 18 - Cellule compagne entourée par des
adénocytes (M.E.T.). |
Fig. 19- Autres cellules compagnes entourées par des
adénocytes (M.E.T.). |
|
| A,
adénocytes ; Dy, dictyosome ; Ip, inclusion
paracristalline ; L, lysosome ; Mt, mitochondrie
; N, noyau. E, parties de cellules en
dégénérescence présumée. |
||
2.2.4- Cellules épidermiques banales
Périphériques
ou logées entre les cellules des
canalicules et de soutien,
elles rappellent ces dernières par l’aspect
ultrastructural, leur sont probablement apparentées, ont un
contour assez irrégulier, s’engrènent par les interdigitations de leurs faces
latérales et sont unies aussi par des desmosomes subapicaux.
Leur pôle basal repose
sur les cellules canaliculaires et émet des prolongements entre les adénocytes. Le
pôle apical est
hérissé
de microvillosités peu nombreuses, montrant une densification terminale au
contact de la cuticule sus-jacente et envoie parfois des expansions dans
cette dernière (Fig.20). Le noyau est haut
situé, anguleux, pourvu d’une chromatine marginale très dense et d’un nucléole
sub-central. Le cytoplasme est abondant, assez clair, renferme
des mitochondries ovoïdes, quelques complexes golgiens, du glycogène, des ribosomes, ainsi que quelques flaques de
matériel grenu (produit de sécrétion ?).
2.2.5- Cuticule
Autour
de l’organe
rétrogonoporal,
le revêtement
cuticulaire est
épais, plissé, formé par de l’épicuticule dense et par de l’endocuticule stratifiée, moins opaque
aux électrons. Il repose sur les microvilli des cellules épidermiques banales et est creusé de pores-canaux. Ces derniers se terminent en
cul-de-sac sous l’épicuticule
et sont
occupés par les
expansions apicales des cellules épidermiques (Fig.20).
Au niveau de
l’organe, la cuticule diminue brusquement
d’épaisseur, réduite environ à son cinquième,
l’endocuticule ayant pratiquement disparu. L’épicuticule constitutive est en
continuité dans les pores avec celle des canalicules excréteurs (Fig.20).
 |
| Fig. 20-
Revêtement cuticulaire et cellules
épidermiques (M.E.T.) |
| A, adénocyte ; C, cuticule
(épicuticule) ; Cd, cellule du canalicule entourant ce dernier ;
N, noyau ; P, pore. |
2.2.6- Muscle
Il est
formé par des
fibres striées très minces
(épaisseur : 6 µm) s’accolant à la lame basale par leur
sarcolemme.
Ces fibres sont pourvues de noyaux marginaux oblongs (longueur : 7,5 µm) à chromatine condensée en grosses mottes. Leurs sarcomères (longueur moyenne : 6 µm) sont compris entre des bandes osmiophiles («stries» Z) très apparentes ; ils montrent des myofilaments fins et épais qui alternent avec régularité.Le sarcoplasme contient du réticulum lisse tubuleux et des mitochondries surtout visibles près du noyau.
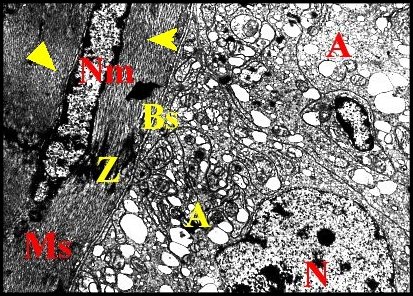 |
| Fig.20.- Fibre musculaire striée séparée des adénocytes par la basale (M.E.T.) |
| A, adénocytes avec des replis du plasmalemme - Bs, lame basale et sarcolemme accolés - Ms, muscle strié et son noyau (Nm) -N, noyau d'adénocyte - Z, strie Z. Flèches : myofilaments (© A.Lopez M.E.T). |
Commentaires
Sur le plan anatomique, le
groupement des adénocytes labioépigastriques en
organe bien délimité, reste une particularité des
femelles de Lepthyphantes sanctivincentii. Cet organe est en tout point
semblable par
son origine et sa cytologie, aux unités glandulaires
isolées ou plus ou moins dispersées mises en
évidence chez les Linyphia,
autres Linyphiidae,
en particulier L.
triangularisLopez,1981b), ainsi
que chez des
femelles de familles différentes (Kovoor, 1981). A son
emplacement, les mâles ne possèdent aucune formation
comparable : les organes
prégonoporauxLopez,1974a ;
Lopez,1974b ; Lopez,1977)
de l’appareil épigastrique (confere
supra) ont une localisation, une structure totalement
différentes et ne peuvent lui être homologués. (Clerck)
( (L’organe
rétrogonoporal de Lepthyphantes
sanctivincentii se présente donc comme un caractère
sexuel secondaire propre à la femelle.
Alors que les autres glandules tégumentaires sont dispersées dans l’épiderme de la région
génitale (Kovoor,1981), l’organe rétrogonoporal
peut être considéré comme une glande
«anatomiquement définie», au sens de Noirot et
Kennedey (1974), la cohésion et
l’ «emballage » des
unités fonctionnelles y étant assurée par les
cellules compagnes ou de soutien.
Une ultrastructure fondamentale analogue est
connue chez les Araignées dans la glande
tibiale d’Alopecosa,
la glande clypéale ou acronale des Argyrodes
(confere supra) et l’organe
rétro-gnathocoxal de Leptyphantes (confere supra).
Toutefois, ces deux derniers sont dépourvus de cellules compagnes ou de soutien, et possèdent au moins 2
cellules canaliculaires par unité fonctionnelle.
Bien que la structure fine du canalicule récepteur soit « obscurcie »
par le feutrage qui l’entoure, il semble bien ne
pas exister de fenestration pariétale ; la
sécrétion doit donc y pénétrer
par une ouverture de l’extrémité distale comme dans le
cas de la glande
tibiale et dans certaines glandes d’ Insectes
Machilidae et Staphylinidae (Bitsch & Palevody, 1976 ;
Araujo,1981).
Les corps
myéloïdes sont semblables, quoique en moins grand
nombre, à ceux des adénocytes
dans la glande
rétro-gnathocoxale de Leptyphantes (Lopez,1988) (confere supra) et dans
diverses glandes phéromonales d’Insectes (Blatte Blaberus :
Quennedey & Brossut, 1975 ; Chrysopa : Wattebled
& al., 1978). Ils ont peut être aussi une origine golgienne
mais correspondent moins à des composants figurés de la
sécrétion qu’à des membranes
sacculaires dégénérées et
phagocytées par les lysosomes.
Ces derniers, qui ont surtout un aspect de corps
multivésiculaires, pourraient
traduire par leur abondance un processus d’ autolyse de l’adénocyte, ou un recyclage de produits de
résorbtion utilisés à nouveau pour des
synthèses ultérieures comme chez les Insectes
(Bitsch & Palevody, 1976).
Sur
le plan fonctionnel
biosynthétique, l’activité des adénocytes ne doit
pas être orientée vers une production majeure de proteines car le réticulum
endoplasmique granulaire est peu développé,
contrairement par exemple à celui de la glande acronale des Argyrodes (confere supra).
La sécrétion est
probablement complexe, formée par un mélange de
matériel golgien et réticulaire, mais sans
participation des curieuses inclusions
paracristallines de cellules
compagnes ou de soutien (Fig. ). Ces inclusions ne sont pas des cristaux de guanine, eux aussi
associés à du réticulum
mais présentant un aspect figuré complexe
différent (Seitz, 1972). Il pourrait plutôt s’agir soit de
déchets puriques, soit de granules pigmentaires non
mélaniques. Par ailleurs, le pôle
basal del’adénocyte ne montre pas l’ association chondriome-replis membranaires traduisant un flux liquidien intense, rapide, et
une sécrétion abondante telle qu’on l’a décrite
dans des glandes défensives (Araujo & Pasteels, 1985) et,
chez les Araignées, dans la spermathèque
de Telema tenella (Lopez,1983b).
Il est enfin possible que le muscle assure en se contractant une
compression des adénocytes
et le rejet rapide
des secreta comme cela est également suggéré pour
certaines glandes d’Insectes où
la musculature a un aspect analogue (Dallai, 1967 ; Dallai &
Melis, 1966-1967)
En ce qui concerne le rôle de l’organe rétrogonoporal, il pourrait permettre à la femelle de Leptyphantes sanctivincentii d’attirer le mâle si l’on extrapole à cette Araignée des données ultrastructurales obtenues chez les Insectes. Le groupement des cellules glandulaires en organe compact accroîtrait la concentration du produit excrété et la cuticule modifiée favoriserait son évaporation comme un diffuseur.
La phéromone qu’il véhicule agirait à distance sur le mâle, induisant un comportement de « cour », peut-être semblable à celui que l’on connaît déjà chez Leptyphantes leprosus (Ohlert)(Van Hesldingen,1965). Toutefois, faute de recherches comparatives plus poussées sur la région génitale des Linyphiidae, et ignorant encore si un organe rétrogonoporal existe aussi chez les Leptyphantes épigés, nous ne pouvons préciser si la vie souterraine conditionne son existence.
Liens externes
https://fr.wikipedia.org/wiki/Glande_r%C3%A9trogonoporale#cite_ref-+1_3-1
Cette
présentation dans "Wikipédia" est incomplète car
inachevée par l'auteur (A.L.) : il
y manque notamment les Commentaires et une grande partie de la
Bibliographie.
Bibliographie
Araujo, J., 1981.- Arch.Biol.,92, p.185-201.
Bitsch, J., 1981 .- Int.Journ.
Insect
Morphol. Embryol., 10, 3, p.247-263.
Dallai,R., 1967.- Atti Acad.
Fisiocritici.,Ser XIII, XVI, p.1117-1143.
Kovoor,J., 1981.-
Atti Soc. Tosc.Sci. Nat.,
Mem., ser.B, 88, suppl., p.1-15.
Krafft,B., 1980.- Verhand.8.Int.Arachnol.Kongr.,Wien, 1980, Verlag H.Egermann,Wien, p.197-213.
Lopez,A.,1983b
(avec L.Juberthie-Jupeau).-
Mém.Biospéol, X, p. 413-418.
Lopez,A.,1974a.- Forma et Functio, 7, p.317-326.
Lopez,A.,1974b-
Bull.Assoc.Anat.,58
(n°163),
p.899-904.
Lopez,A.,1977. – Contribution
à l’étude des caractères sexuels somatiques chez
les mâles d’Aranéides. Thèse doct.Etat es.
Sciences, Univ.Sci.Tech., Montpellier, Avril 1977, 117 pp.
Lopez,A.,1979b (avec R.Mazel, F.Marcou, J.Faure, J.Guilhaumon, J.Delabie).- Bull.Soc.Et.Sci.nat.Béziers, N.S., VI, Vol.47, 1978, p.4-37.
Lopez,A.,1989
(avec L.Juberthie-Jupeau).- Mem. Biospéol., XVI, p.241-249.
Noirot, Ch. &
A.Quennedey, 1974.-
Ann.Rev.Entomol.,19, p.61-80.
Quennedey A. &
R.Brossut, 1975.-
Tissue and Cell, 7,3,p. 503-517.
Seitz, K.A., 1972.- Z.Morph.Tiere, 72,
p.245-262.
Tietjen,W.J.
& J.S.Rovner, 1982.- Spider
communication in Shear, W.A.edit. : Spiders, Webs,
Behavior and Evolution, p.249-279.