

Punaises
et plantes
(Colchique, Rouvet)
Punaises, Colchique, Rouvet
|
AU SUJET D’INSECTES HÉTÉROPTÈRES PENTATOMORPHA ET DE LEURS PLANTES HÔTES, NOTAMMENT LA « PUNAISE À DAMIER » ET LE COLCHIQUE DE NAPLES Par
André LOPEZ
(Version
2025 et
article ultime de l'auteur*)
|
|
Couleurs
conventionnelles :
En noir et italiques, termes anatomiques ; en violet,,
noms
génériquess et spécifiques ; en kaki,
noms vernaculaires et non linnéens ; en marron, termes biologiques et
chimiques
-en vert, noms de
familles et
sous-familles ; en bleu clair, noms de
groupements plus élevés ; en bleu foncé, liens ;
en orange,, parties importantes
et résumés.
|
Dans
un article précédent, déjà ancien, l’auteur
a décrit les relations singulières
existant entre deux Insectes Hétéroptères
Pentatomorphes et deux plantes
faisant partie de familles bien distinctes : d’une part Lygaeus
saxatilis Scopoli. et le Colchique
de Naples
(Colchicacées),
d’autre part Sehirus dubius
Scopoli. et l’Osyris ou Rouvet (Santalacées)(Lopez,2003).
En
fait, selon la nomenclature linnéenne actuelle, le premier
Hétéroptère
doit
être rattaché à un genre différent et
devient ainsi Spilosthetus
saxatilis (Scopoli), la
« Punaise à
damier ».
Quant
au second, Sehirus
Amyot &
Serville, inclus par beaucoup dans le genre Canthophorus
Mulsant & Rey, il
crée toujours
des polémiques. En
témoigne
le site IT (22
juillet 2022), qui considère Canthophorus
comme un synonyme invalide de Sehirus, tandis qu'il est reconnu aujourd'hui par la communauté
scientifique, à la suite de Gapon
(2018). En outre, un examen
plus attentif des
adultes (hémélytres
et abdomen) a conduit l’
auteur
à réviser depuis sa
diagnose : l’Hémiptère lié au Rouvet
doît être traité comme étant en fait Canthophorus
melanopterus, le « Canthophore à ailes
sombres » ou « Cydnidé
bleu ».
De
plus,
toujours dans l’article de 2003, il
était seulement
évoqué un « motif
nutritionnel » et une relation
« indiscutablement trophique » entre l’insecte et
son hôte végétal,
négligeant ainsi quelque peu l’étrange biologie des
Pentatomorpha axée, en bonne
partie, sur leur défense contre
les prédateurs dans le cadre d’un
« avertissement » ou
« aposématisme ».
Le
nom Colchique, Colchicum,
est dérivé de Colchide, Colchis ou Kolchis (dans les
langues géorgienne et iaze :
კოლხეთი, k'olkhéti ;
en
grec Κολχίς, Kolchis, sans doute lié à khalkos
qui désigne le
cuivre) ancien royaume puis région de Géorgie. Le plus
grand nombre d'espèces
se rencontre en effet dans les Balkans et en Asie mineure. Un
Colchique,
surtout celui d’ automne (C.autumnale),
est également appelé, du moins en France, «safran
bâtard», «safran des prés» ou
encore, du fait de sa grande toxicité, «tue-chien».
La
nomenclature du genre Colchicum dont
il existe une bonne centaine d’espèces, est actuellement
confuse. L'identification
correcte d'une espèce nécessite souvent un examen
attentif des fleurs et des
feuilles, ce qui est en
pratique difficile à réaliser sur
le terrain. Comme
mentionné ci-dessous, les feuilles
et les fleurs de la
plupart
des espèces
apparaissent en effet à des saisons différentes.
Dans
la classification habituelle
de Cronquist (1981), il se rattache à la classe des Liliopsida,
sous-classe des
Liliidae, ordre des Liliales et famille des Liliaceae. Dans la
classification
phylogénétique, il fait toujours partie des Liliales mais
individualise la
famille des Colchicaceae.
Le
Colchique de Naples a
été
observé en Biterrois de 1995 à 2003 au Printemps et en
Septembre-Octobre, puis
à nouveau en 2024, non sans des
limites dues à la sècheresse.
La population la plus
rapprochée de Béziers se situe dans
une pelouse à
Brachypodes, près du Canal du Midi et en contrebas de la colline
d’Ensérune, au
lieu dit « le Malpas » (Fig.3,4,5,7). Les autres
sont connues du
Saint-Chinianais et du Pardailhan de
fossés,
talus herbeux et friches: bord de routes entre Saint-Chinian et
Donnadieu, Cazedarnes
et Pierrerue, Assignan et Coulouma mais aussi, en pleine
garrigue rocailleuse
comme à Marcory, proche de Copujol (Lopez,2003),
à Gimios près de Barroubio et jusqu’en Minervois
au-dessus de la grotte du
Gourp des Bœufs.
Le Colchique
de Naples Colchicum
neapolitanum Ten.
(C.arenarium G.G
ou C.longifolium
Castagne),
non décrit dans la note antérieure
(Lopez,2003),
est une plante herbacée vivace
de l'Ouest
méditerranéen.
Comme
le Colchique d’
Automne,
il fait partie des
espèces à tépales
soudés. De petite
taille (h = 10-20 cm), glabre, il est
pourvu d’un pseudo-bulbe
large de 2 à 3 cm, le corme,
que
forme une tige
renflée entourée par des écailles noirâtres.Ses feuilles radicales sont peu
nombreuses
(trois à quatre), dressées ou étalées,
étroites, allongées, lancéolées ou
linéaires-
lancéolées, obtuses (Fig.1,2),
n'apparaissant qu'au printemps
qui suit la floraison avec le fruit
qu'elles
entourent (Fig.2 : flèche).
 |
 |
| Fig.1 - Colchicum neapolitanum, feuilles | Fig.2
- Colchicum
neapolitanum, feuilles et fruit encore vert (flèche) |
La
fleur, automnale
(Août-Septembre), est souvent solitaire (Fig.3), rarement
géminée (Fig.4) ou ternée,
assez grande, sans hampe, et
parait sortir directement du sol. Elle
montre un
très long tube
blanchâtre dressé (Fig.3,4) et un
périanthe en entonnoir
rose-mauve, long de 3 à 5 cm, avec six divisions ou
tépales
lancéolés-oblongs, pourvus de stries non ou peu
ondulées (Fig.3 à 6). Les six
étamines sont toutes
insérées en couronne, sur un
seul rang, à la même
hauteur et les trois styles,
qui les égalent ou les
dépassent, ont des
stigmates en massue, un peu
courbés (Fig.5,6). Une telle
inflorescence
ressemble à celle des Crocus pourvus toutefois de
trois
étamines au lieu de six.
 |
 |
 |
| Fig.3
- Colchicum
neapolitanum, fleur en vue latérale. Le Malpas |
Fig.4 - Colchicum neapolitanum, deux autres fleurs en vue latérale. Le Malpas | Fig.5 - Colchicum
neapolitanum, deux autres fleurs en vue plongeante Le Malpas |
 |
 |
| Fig.6
- Fleur : tépales (certains rabattus), étamines et
pistil. Le Malpas |
Fig.7
- Fruit mur , ouvert, avec ses valves contenant des graines |
 |
| Fig.8 - Lis du Malabar cultivé : fleurs
et tiges montrant quelques vrilles. |
Au
point de
vue chimique, la colchicine,
poudre cristalline blanche ou
jaune pâle, est un alcaloïde de
formule C22H25N06, de structure tricyclique
(Fig.9), à deux énantiomorphes :
la
(R)–colchicine et la (S)-colchicine, cette
dernière,
isolée par deux chimistes
français, Pelletier
et Caventou (1820)
, associant, très curieusement,
le
Colchique
d’ Automne et... les
Vérâtres (Melanthiaceae),
également toxiques, dans la
famille dite des
« Colchicées ». Elle possède des
activités pharmacologiques qui,
depuis,
ont fait toute sa renommée.
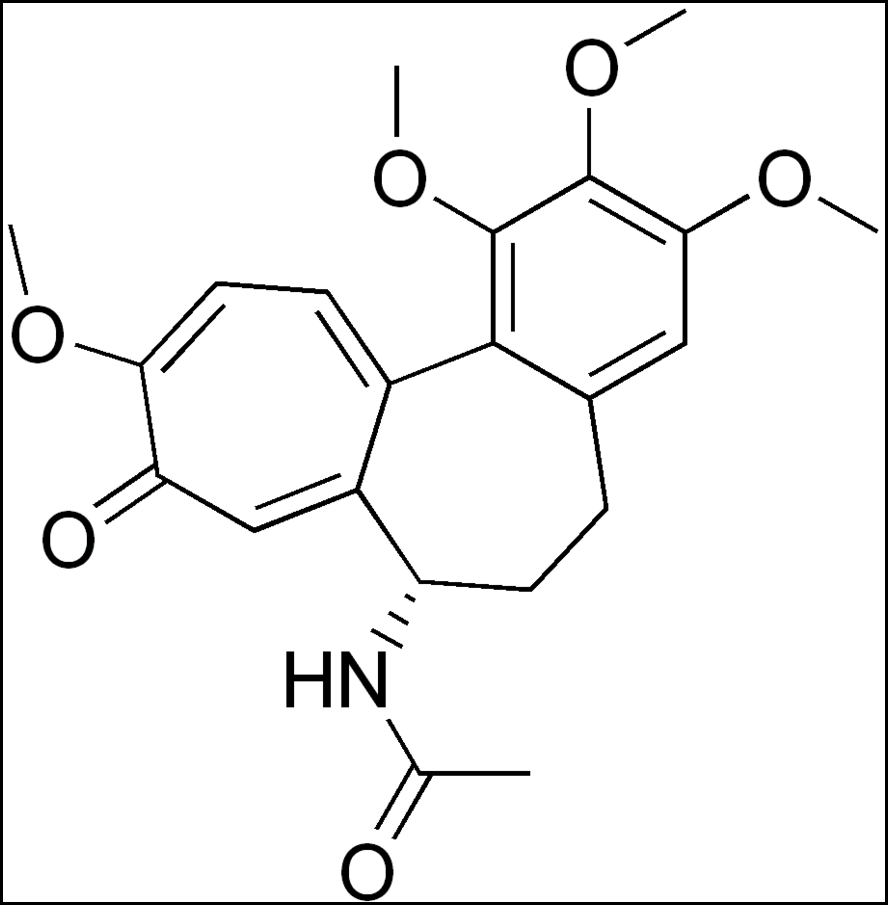 |
| Fig.9 Structure de la Colchicine |
Sur
le plan cellulaire ultrastructural, la
colchicine présente
l’étrange propriété
de désorganiser une
partie du cytosquelette,
polymères protéiques
résistant à la déformation et
transmettant les forces mécaniques dans la cellule. Non pas
les filaments
d’actine et intermédiaires,
mais les microtubules, tiges
rigides
et creuses à
sous-unités de tubuline
qu’elle dépolymérise . Il
s’ensuit une inhibition de la
mobilité des leucocytes
polynucléaires neutrophiles,
de
leur
adhésivité à l'endothélium
des
vaisseaux et une neutralisation
partielle
de l' inflammasome,
complexe protéique
impliqué dans
le système immunitaire.
Du
fait de cette activité anti-inflammatoire, la colchicine est
utilisée
comme médicament,
l'extrait
de plante étant connu depuis l’antiquité
(Pedanius Dioscoride,
env.40
-env. 90) pour
traiter notamment la
« podagre » goutteuse.
On
l’utilise
aujourd’hui en médecine humaine contre
les maladies
articulaires dites à
« microcristaux » : acide urique (goutte) ;
pyrophosphate de calcium
ou hydroxyapatite
(chondrocalcinose, étrange syndrome cervical hyperalgique de
« la dent
couronnée » par
atteinte du ligament
rétro-odontoïdien de l’atlas, soit dit en passant, diagnostiqué et traité par l'auteur chez
son épouse). Plus
rarement, elle est prescrite dans la maladie périodique
ou fièvre
méditerranéenne génétique,
dans le syndrome ou maladie
vasculaire de Behçet et certaines péricardites.
Elle a été considérée enfin,
probablement à tort, comme pouvant protéger des maladies
cardio-vasculaires et
même du Covid-19 ! Dans tous les cas, elle doit être
maniée avec une précaution
extrême car il s’agit d’une substance de haute toxicité
à balance
bénéfices-risques défavorable aussi bien pour
l’homme que pour le bétail. Son
administration est utile jusqu’à 10 mg mais au delà,
doit être interrompue
impérativement lorsque survient une diarrhée
car elle se rapproche alors
de la dose mortelle, avec paralysie
neuro-musculaire, destruction des cellules sanguines, convulsions,
atteinte
rénale, choc septique et, enfin, détresse respiratoire
terminale. En Inde et au
Sri-Lanka, des suicides seraient dus à la colchicine de Gloriosa (Fig.8)
par ingestion de son rhizome !
Signalons
par
ailleurs, que du fait de son activité inhibitrice
sur la
polymérisation des microtubules,
un tel est souvent
utilisé au laboratoire pour établir un caryotype par
blocage de la mitose
en métaphase,
stade
où les chromosomes
deviennent apparents. L’action
délétère sur le fuseau
mitotique des Insectes, donc leurs microtubules, est connue expérimentalement
depuis Dooley (1939) mais
paraît, jusqu’ici, peu
documentée
(Orthoptères, Coléoptères, Diptères).
Spilostethus
saxatilis
(Scopoli, 1763) fait
partie de la famille des Lygaeidae
(Hemiptera
> Heteroptera >
Pentatomorpha> Lygaeoidea> Lygaeidae) dans
l’une de ses trois sous- familles, les Lygaeinae.
La famille a une répartition
cosmopolite,
avec 38 espèces
et 16 genres en
France (in Fauna Europaea,13
novembre 2022). Il s’agit d’une espèce
ouest-paléarctique présente depuis l’Espagne et le
Maghreb jusqu’au Caucase et
l’ Afghanistan. Elle est sensée préférer les
reliefs aux plaines (jusqu’à plus
de 1000 ms) et vivre
dans des milieux assez frais et ensoleillés, notamment , les
paturages, les
orées forestières, les friches et les jachères
sans que la garrigue ou matorral
soit évoquée.
Etymologiquement,
« Spilostethus», qui a
succédé à « Lygaeus »,
signifie en latin « avec des taches sur le
thorax »
et « saxatilis »,
« du rocher », allusion possible à un
habitat montueux et peut être
montagnard sus-mentionné.
Long
de 8,5 à 13 mm (mâle
plus petit que la femelle), Spilostethus
saxatilis est ovale allongé, aplati
dorso-ventralement, bicolore, avec des
taches noires sur fond rouge
« criard », une
livrée très voyante propre à tout le genre (Fig.10
à 13). La tête porte
les
yeux, cernés par un H
noir, des antennes à 4
segments et
un rostre ventral
piqueur-suceur. Le pronotum montre un grand motif
formé par deux
larges bandes noires quadrangulaires
un peu convergeantes s’étirant en avant
jusqu’au dessin périoculaire et atteignant en arrière le
scutellum, entièrement
noir. La corie ou
partie basale indurée de chaque aile
antérieure (hémélytre)
présente trois dessins noirs, l’un
petit et interne sur le clavus,
les deux autres, plus grands et externes, l’antérieur en
triangle et le
postérieur, incurvé-claviforme, atteignant
par son « pied » la membrane,
zone apicale de l’aile,
entièrement noirâtre, sans macules blanches. Sur
la face ventrale (Fig.12),
la couleur noire laisse
apparaître le fond rouge vif dans des plages
thoraciques anguleuses et cinq bandes
abdominales festonnées se
prolongeant
dorsalement sur le connexivum. Les
pattes noires ont des tarses à 3 articles.
L’ensemble
très complexe d’une telle ornementation
et non le seul dessin pronotal, comme
l’ont
écrit certains auteurs, a valu à l'insecte son nom
courant de "Punaise à
damier".
 |
 |
 |
|
Fig.10
- Spilostethus
saxatilis à terre,
vue dorsale.
|
©
Fig.12 - Autre individu,
sur Colchique, vue
latéro-ventrale gauche.
|
©
Fig.11
- Autre individu, sur
Ombelle de Buplèvre, vue dorsale.
|
 |
| Fig.13-
Accouplement à terre de Spilostethus
saxatilis, vue dorsale. |
Ainsi
décrit, Spilostethus
saxatilis ne doit
pas être confondu avec deux autres espèces du
même
genre, Spilostethus pandurus (Scopoli)
et
S.furcula. Le
premier (Fig.14, 24) se
caractérise par deux bandes
pronotales
étroites,
sinueuses et divergeant en arrière, par une petite macule
arrondie sur les
clavus des cories et surtout par trois taches
blanches sur les
membranes, la
plus grande arrondie et centrale, une autre
arquée. Le
second (Fig.15), d’origine
africaine et parvenu en France avec le réchauffement climatique,
montre un
pronotum orné de deux
larges bandes longitudinales droites, non
arquées, un scutellum noir à
apex rouge et des cories
portant
deux taches noires, une étroite sur le clavus et une large en
bande
triangulaire transversale. Les membranes
sont grises.
 |
 |
| Fig.14 - Spilostethus
pandurus, vue dorsale
|
Fig.15 - Spilosthetus
furcula,
vue
dorsale |
D'autre part, il doit être
différencié de la «Punaise
écuyère», Lygaeus equestris
(Fig.16),
considérée initialement comme un Spilostethus.
Fréquente
dans la dition
bitteroise, elle se caractérise
par un pronotum à motifs noirs
transversaux, un scutellum
tout noir, une tache punctiforme et
une bande transversale
massuée de même couleur
sur la corie et une membrane noire ornée de taches blanches
évoquant celles de Spilosthetus saxatilis.
 |
| Fig.16- Lygaeus equestris, vue dorsale |
Dans
tous les cas, les couleurs voyantes composant des livrées ainsi
bariolées
entrent dans le cadre plus
général de
l’aposématisme.
Ce
dernier (du
grec ancien ἀποσημαίνω,
aposêmaínô
= annoncer par des signes, signaler)
l'est l'ensemble des mécanismes grâce
auxquels un animal envoie un signal clairement
perceptible pour des prédateurs potentiels afin
de les prévenir qu'il n'est pas comestible et représente
même un réel danger
lié à sa propre toxicité. Ce signalement,
d’emblée visuel (coloration et
livrée voyantes),
peut être aussi
sonore et donc acoustique (stridulation
de Pentatomides) ou
olfactif : émission par des glandes
métathoraciques
et
leur appareil externe dont Carayon (1971)
a fait le point, de
molécules sémiochimiques
perçues
comme malodorantes, d’où leur nom
commun
français général de
« Punaises » issu du
bas latin putinasius (« qui sent
mauvais » de putere =
« puer » et nasius =
« nez »). Les
plus abondantes sont des
aldéhydes aliphatiques
et aromatiques auxquelles
ont été attribuées
plusieurs fonctions :
fongistatique et microbicide, sociale pour l’agrégation
des
Lygaeidae (Fig.21)
et des Pyrrhocoridae,
surtout répulsive notamment pour l’homme, et même toxique.
En fait, cette
dernière est bien souvent indépendante du produit
des glandes métathoraciques car
l’action
délétère se trouve plus
souvent liée à
des végétaux dont se nourrit l’ insecte.
Le
phénomène
de l’aposématisme n’est pas fortuit mais implique chez les
Carnivores, qu’il sagisse de
Vertébrés (des Batraciens
aux petits Mammifères), d’ Arachnides ou
d’Insectes un certain
« apprentissage » préalable. Ce dernier
établit un lien entre des contacts
antérieurs désagréables avec les proies
potentielles, ici des d’Hétéroptères, et les
couleurs contrastées qu’elles
arborent , et dont les prédateurs finiront ainsi par se
détourner.
Spilostethus
saxatilis se rencontre régulièrement
sur les Colchiques de Naples, isolé ou en petit nombre, parfois accouplé
en position
tête-bêche (vulgairement
"cul
à cul") (Fig.13,17), y occupant
les feuilles et la capsule au Printemps,
les fleurs à la fin de l'Eté (Figs. 18). Il se tient immobile ou déambule à l'aisselle des feuilles
ou sur les périanthes, et s’enfuit avec
vélocité lorsqu’on l'importune, sans toutefois s’éloigner beaucoup du pied d’où il peut,
toutefois, en gagner
d’autres (Fig.19 ). L’insertion de son rostre
dans le végétal a pu
être photographiée
(Fig. 20, à gauche). En revanche,
les
anthères
et le pistil
paraissent parfois
endommagés et comme
dilacérés lorsqu’il occupe la corolle
(Fig.18 et f.4, p.31, in
Lopez,2003).
Bien
qu'il soit capable de
voler, Spilostethus n'aime
pas aller
très loin, et ne s'éloigne donc guère de la plante-hôte.
En revanche, il ne
semble pas y manifester le phénomène de groupement
social, pourtant observé sur
d’autres végétaux (Fig.21).
Un
tel comportement a été observé par l’auteur et
Francis Marcou dans les seules stations mentionnées plus haut
aux Avant-monts,
toujours situées à une certaine altitude ( 300 à
600 m. environ).
 |
 |
 |
| Fig.17 - Accouplement sur une
feuille. Vue dorsale Assignan |
Assignan
|
© Fig.19 - Individu passant d'un Colchique
à d'autres. Vue dorso-latérale gauche. Gimios. |
 |
 |
| Fig.20 -
Deux autres individus sur un même Colchique, celui de
gauche insérant son rostre dans la plante. Assignan. |
A
titre comparatif, deux autres
populations de Colchiques
situées pratiquement en plaine, celle
du Malpas (50
m.), sur Nissan, et l'autre à Cazedarnes (route de
Pierrerue)(100 m.) n’ont
jamais révélé à l’auteur une
fréquentation par Spilostethus
saxatilis,
pas
plus d’ailleurs, dans le premier cas que
celle de son congénérique, S. pandurus, pourtant
observé tout près,
à Colombiers (Fig.24) . Le Colchique
de Naples semble exercer aussi un même effet attractif
puissant sur Spilostethus
saxatilis en dehors de notre dition
loco-régionale. En effet,
d'après Internet, il apparait
aussi dans d'autres
départements méditerranéens tels que le Var,
à Roquebrune sur Argens, sur une
image de Roland Lupoli (Fig.22) consacrée au seul Colchicum
longifolium,
la présence de la punaise
y étant traitée comme
fortuite.
 |
| Fig.22
- Spilostethus
saxatilis sur un
Colchique de Naples photographié dans le Var (R.Rupoli).
|
IV -1 -
INFEODATION AU GENRE
COLCHICUM
Ils ont
étudié quatre
espèces de
« milkweed bugs » dont Lygaeus
equestris, Spilostethus
pandurus et S. saxatilis, tous
membres du clade des Hétéroptères
Lygaeinae associé ancestralement
à la famille des Apocynaceae.
En tant que polyphages, les deux
premières,
surtout Lygaeus, peuvent
se nourrir sur de nombreuses
autres familles de plantes, notamment les Asclepiadaceae, Asparagaceae,
Brassicaceae, Plantaginaceae, Ranunculaceae,
produisant, par convergence ,des cardénolides
ou glycosides cardiotoxiques. En
revanche, Spilostethus saxatilis, est
obligatoirement
associé avec
les Colchicaceae
en l’occurrence Colchicum
autumnale dont la
colchicine n’a aucune
parenté chimique avec les
précédents. L’absence naturelle
de cardenolides dans son
organisme
suggère que cette espèce a complètement
dévié de leur usage pour
adopter un
nouveau mode chimique de
défense, bien qu’elle tolère
néanmoins ces glycosides
lors d’un régime végétal en laboratoire (Espinosa,
2023). L’adaptation
profonde du S. saxatilis
au C. autumnale est
indéniable. En
effet, la colchicine,
ainsi que d’autres
alcaloïdes
apparentés (colchicoïdes)
a
été trouvée dans une trentaine de
spécimens provenant de onze pays européens et d’Afrique
du Nord. De plus, elle
a été extraite des œufs en
quantité importante
et l’on a même pu constater des
pontes
dans des semences de
Colchicum, ce qui
prouve le degré considérable
d’inféodation. Il
n’est
pas toutefois
précisé, sur le plan anatomique, le lieu potentiel
d’accumulation de la colchicine
dans l’organisme de Spilostethus
saxatilis : hémolymphe de sa cavité
générale et peut
être, ce qui serait beaucoup plus original, des
compartiments
tégumentaires
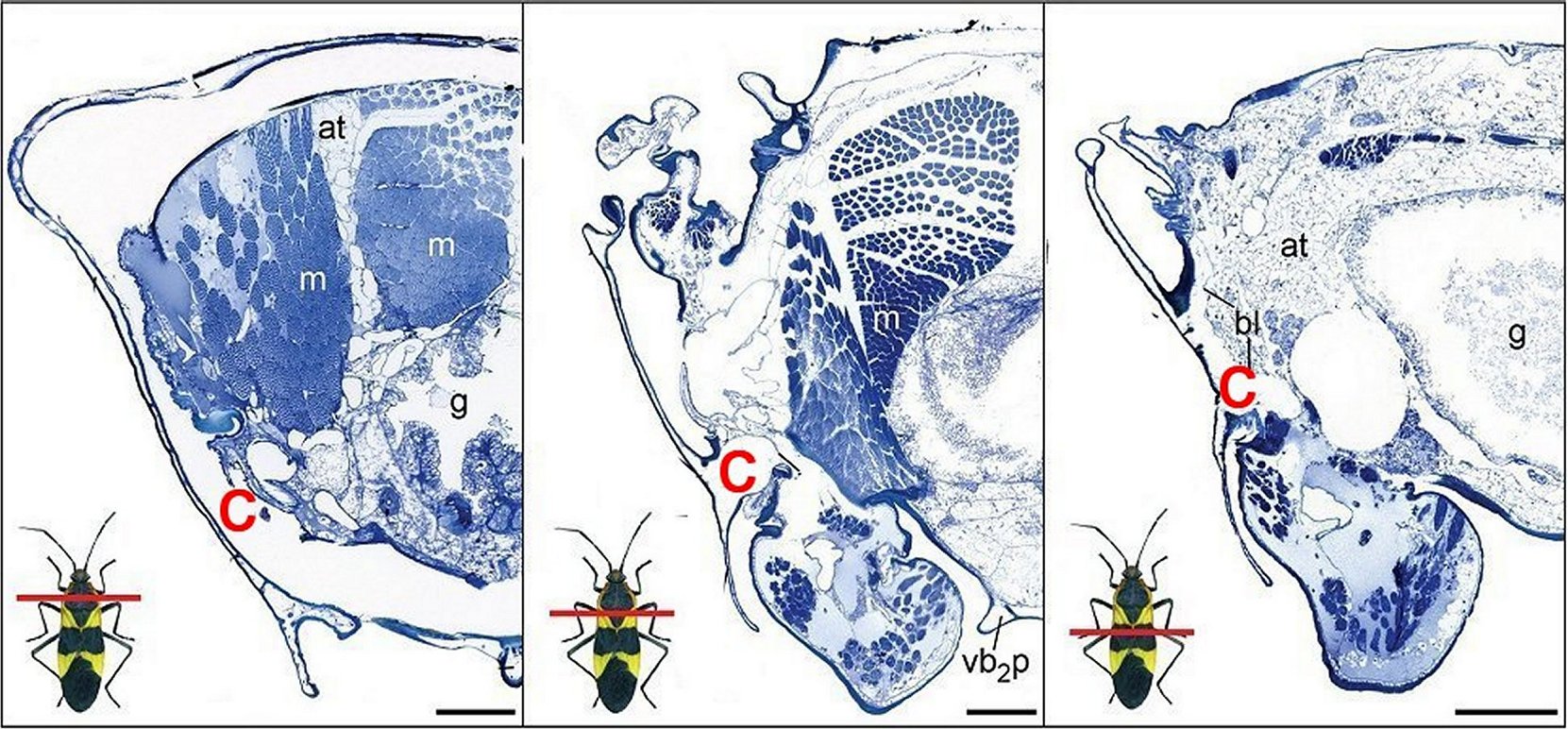
spécialisés se situant sous la cuticule. Bramer
&
al.(2017) les y ont
découverts par microtomographie et
par
coupes histologiques transversales sériées à trois
niveaux (Fig.23,C, d’après
Bramer) notamment dans le genre voisin Oncopeltus,
d’où la toxine, en l’occurrence un glycoside cardiaque, est
extrudée lors de
l’attaque par un prédateur avec effraction possible du corps de
l'Hémiptère.
 |
|
Fig;23
- Série de trois coupes histologiques sagittales d' Oncopeltus
passant par trois niveaux différents du thorax.
C, compartiments cuticulaires sensés contenir les toxines. (d'après Bramer & al.) |
De
son coté, dans la droite
ligne de son
congénérique,
Spilostethus pandurus se nourrit sur
d’autres plantes toxiques de famille des Asclepiadaceae,
des Solanaceae (Datura)
et, comme mentionné ci-dessus, des Apocynaceae
telles
que le Laurier
rose.
Lorsque
la punaise
fréquente ce
dernier (Fig.24), il a été trouvé dans ses tissus
corporels deux hétérosides
cardiotoniques, dont l’odoroside-H)
(Euw & al.,1971)
qu’elle
est capable de « séquestrer » et ensuite
de libérer par
ses glandes - ou sa cuticule ! -,
repoussant ainsi, du moins expérimentalement et
sans doute aussi
sur le terrain, les attaques d’autres arthropodes ( scorpions, mantes),
d’
oiseaux et de chat.
 |
| Fig.24 - Spilostethus
pandurus sur un fruit de
Laurier rose (Colombiers) |
Quant
à Spilostethus
furculus (Fig.15), non encore rencontré
par
l’auteur dans la dition et présenté ici seulement
à titre comparatif, il se
nourrit sur des Solanaceae
très toxiques, notament le Datura
stramonium et
surtout,
Solanum
nigrum, d’où son nom vernaculaire « Punaise des
Morelles » dont il
pique les fruits verts pour
aspirer le jus des graines,
avec son
rostre, absorbant
ainsi des glycoalcaloïdes
toxiques dont la solanine.
En ce qui concerne à nouveau Spilosthetus
saxatilis signalons qu’il n’a pas
l’exclusivité de la
colchicine pour assurer
son métabolisme et sa défense, puisqu’il est
démontré , dans un autre ordre d’
Insectes, les Lépidoptères, que celle du Lis de Malabar
(Fig.8) est également
séquestrée par
le Noctuide
Polytela gloriosae (Fab.).
En tant
que métabolite secondaire végétal,
l’alcaloïde est
présent dans la
quasi-totalité du corps (Sajitha
& al.,2019),
aussi bien chez la chenille (Fig.25)
que
l’imago (Fig.26), tous deux
arborant, ici encore, une livrée
voyante, manifestement
aposématique.
 |
 |
|
Fig.25
- Chenille de Polytela, vue latérale droite.
D'après Internet
|
Fig.26 - Imago de Polytela, ailes repliées,
vue dorsale.D'après
Internet |
Restant
dans le vaste cadre de la
super-famille des Pentatomoidea (infra-ordre
des Hémiptères Pentatomomorphes) et afin de combler une
autre lacune du
précédent article (Lopez,2003),
il est bon d’ aborder
brièvement les Cydnidae
avec
l’espèc Canthophorus
melanopterus. On
sait, rappelons le, qu’il est
inféodé à Osyris alba, Santalacée
hémiparasite dont les haustories
spécialisées
puisent des substances solubles dans
de
nombreuses autres plantes
du voisinage. Certains de ces métabolites secondaires sont
connus comme
toxiques, notamment des alcaloïdes
de la pyrrolizidine
déjà
évoqués dans deux autres articles (Lopez,2003,2016) tels la senecionine,
la retrorsine, l’integerrimine et ceux aussi de la quinolizidine
(sparteine,
cytisine, lupanine, anagyrine (Woldemichael & Wink,
2002),
sans compter l’osyrisine (Al-Jaber & al.,2010).
De ce fait
et bien que souvent mise
en doute,
la toxicité du Rouvet
pourrait bien être réelle, du
moins pour les prédateurs du « Canthophore
à ailes sombres » qui doit
puiser des alcaloïdes
dans les fruits, dont il se
nourrit
assidument (Fig.27,28).
Qui plus est, la livrée
très voyante, rouge cerise et
noire chez les larves
(Fig.27), bleu-violacé métallique et blanche chez
l’adulte (Fig.28), ne peut qu’être
aposématique, la forme de l’abdomen
et
sa couleur chez les premières, contribuant
en outre à les camoufler sur les fruits murs par
phénomènes d’homochromie
et homomorphie
(harmonisations avec le milieu)
 |
 |
| Fig.27
- Larve de Canthophore sur un fruit de Rouvet, vue dorsale |
Fig.28 - Adulte de Canthophore sur
des rameaux de Rouvet , vue dorsale |
Cet
exemple, joint à celui des
Lygaeinae souligne
l’étrange biologie
des Pentatomorpha
axée, en bonne partie,
sur leur défense contre les prédateurs et
parasitoïdes. La
vénénosité
est la partie la plus frappante
de la
stratégie multimodale
de
défense des
Hétéroptères,
incluant
au premier chef l’aposématisme mais
aussi, en confrontation rapprochée,
le fait capital et moins
connu de
leur toxicité. A cet égard, leurs substances chimiques
plus ou moins léthales
pour les prédateurs éventuels sont soit
synthétisées par leur organisme, soit
en ce qui nous a surtout concernés ici, empruntées
par
piqure rostrale à des
plantes hôtes (« sequestration » des
anglophones) suivant une
coévolution complexe d’ Insectes spécialisés (Espinoza,2023) et, particularité
biologique majeure, comblant une importante lacune dans le travail
initial de l’auteur
.
*
Avec la participation de Francis Marcou :Fig. ©.
BIBLIOGRAPHIE
Al-Jaber,
H.,..& O.
Abu Salim,
2010 - Chemical
constituents
of Osyris alba and their
antiparasitic activities
Journal of
Asian Natural Products Research September 2010, 12(9), p.814-20.
Bramer,C.,Friedrich,F. &
S.Dobler, 2017 - Defence by
plant toxins in milkweed bugs
(Heteroptera: Lygaeinae) through the evolution of a sophisticated
storage
compartment. Systematic
entomology, January 2017, Volume
42, Issue1
, p. 15-30.
Carayon,J.,1971.-
Notes et documents sur l’appareil odorant métathoracique des
Hémiptères. Ann.Soc.Entom.Fra
nce.,N.S., 7 (4) , p.737-770.
Dooley,
T.P. ,1939.- The
influence of colchicine on the germ cells
of Insects with
special
reference to the cytoplasmic inclusions. Proceed Iowa Acad.of Sciences,
46 (1),
p.445-446.
Euw,
J. von, Reichstein, T. & M.
Rothschild,1971 .- Heart poisons (cardiac glycosides) in the
Lygaeid bugs
Caenocoris nerii and Spilostethus
pandurus,
Insect Biochemistry, vol. 1, no 4,
1971, p.373-384.
Gapon,
D.A.,,2018
- Morphology
of male and
female terminalia and
taxonomic revision of the burrower bugs genus Canthophorus
(Heteroptera:
Cydnidae) »,
Annales
de la Société
entomologique de France (N.S.),
vol. 54, no 3, 4 mai 2018,
p. 183–228.
Lopez,A.,2003
- Sur qelques relations particulières entre les plantes et les
Insectes.
Bull.Soc.Et.Sci.nat.Béziers, N.S- T.XX-61e volume,année
2002-2003, p.35-39 et
31.
Lopez,A.,2016
-Note sur l' Eupatoire chanvrine (Eupatoria
cannabinum : Asteraceae) et son
Entomofaune dans l 'Ouest de
l'Hérault.
Bull.Soc.Et.Sci.nat.Béziers, N.S.- T.XXVIII - 69e volume,
années 2015-2016,
p.9-18.
Pelletier,
P. J.
& J. B.Caventou, 1820.- Examen chimique des plusieurs
végétaux de la
famille des colchicées, et du principe actif qu'ils renferment.
[Cévadille (Veratrum sabadilla) ;
hellébore blanc (Veratrum album) ; colchique
commun (Colchicum autumnale)]. Annales
de Chimie et de Physique 1820,
14, 69.
Petschenka,G,
Rayko Halitschke,R., Tobias Züst,T, Anna Roth,A., Sabrina Stiehler,S…. & A. Exnerová,
2022
- Sequestration of Defenses against Predators Drives Specialized Host
Plant
Associations in Preadapted Milkweed Bugs (Heteroptera: Lygaeinae) vol.
199 ,
no. 6 the american naturalist june 2022
Sajitha,
T. P., Siva,R. & B.
L. Manjunatha,
2019 - Sequestration
of the plant secondary metabolite,
colchicine, by the noctuid moth Polytela gloriosae
(Fab.)
August 2019, Chemoecology 29(2)